Презентація " Фізичні та хімічні властивості кислот"

























В кінці уроку ви зможете дати відповіді на такі запитання: Що спільного й чим відрізняються кислоти за фізичними та хімічними властивостями? Що таке індикатор? Як з`ясувати, в якій із пробірок без етикеток міститься вода, а в якій – кислота? Які хімічні властивості характерні для кислот? Чи всі метали взаємодіють з кислотами? Що таке реакції обміну та заміщення? Хто склав витискувальний ряд металів і як ним користуватися?
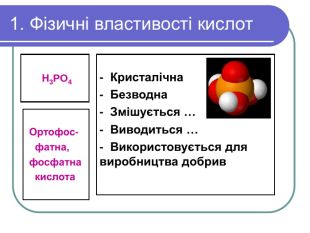
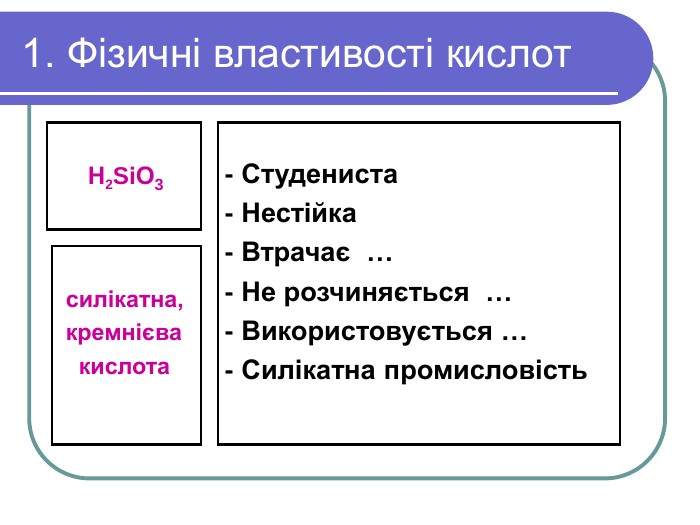
2. Хімічні властивості кислот Кислоти – їдкі речовини. Особливо небезпечні сульфатна, нітратна та хлоридна кислоти. Вони роз`їдають папір, деревину,тканини. Бризки кислоти спричиняють хімічні опіки. Тому поводитися із кислотами треба обережно. Якщо бризки кислоти потрапили на шкіру або в очі, їх треба негайно змити великою кількістю води, промити уражене місце розчином соди і звернутися до медпункту.
Червоний лакмус Рожевий метилоранж Безбарвний фенолфталеїн HCl реактив індикатор Спостереження запишіть до таблиці. лакмус метилоранж фенолфталеїн HCl реактив індикатор Перед виконанням досліду повторимо правила ТБ Перевіримо ваші результати Фенолфталеїн метилоранж лакмус Висновок. Розчини кислот можна виявити за допомогою індикатора метилоранжу або лакмусу. Лабораторний дослід №1 “Дія кислот на індикатори” У три пробірки налийте по 1 мл хлоридної кислоти HCl. Додайте по кілька крапель індикаторів: у першу - фенолфталеїн; у другу - метилоранж; у третю – лакмус.
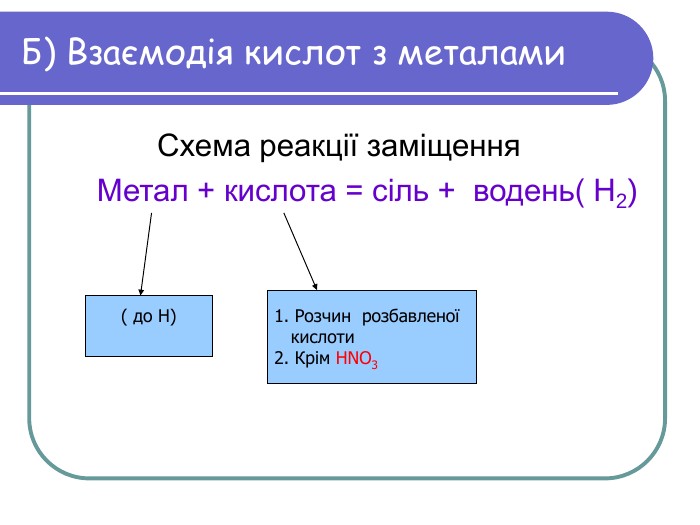
“+” - так, “-” - ні 6. Усі кислоти добре розчинні у воді. 7. Формула кислоти,яка міститься у шлунку HCI. 8. У разі додавання лакмусу в кислоту розчин знебарвиться. 9. Солі силікатної кислоти – силікати. 10. Нітратна кислота реагує з основами. 11. Витискувальний ряд металів склав Д.І.Менделєєв Графічний диктант 1. Кислоти взаємодіють з усіма металами за звичайних умов. 2. Сульфатна кислота є безоксигеновою. 3. При взаємодії кислот з металами утворюється газ водень. 4. Щоб розпізнати серед речовин кислоту, досить скуштувати її на смак. 5. Ортофосфатна кислота – це тверда кристалічна речовина.
7. Формула кислоти,яка міститься у шлунку HCI. “+” 8. У разі додавання лакмусу в кислоту розчин знебарвиться. “-” Солі силікатної кислоти – силікати. “+” 10. Нітратна кислота реагує з основами. “+” 11. Витискувальний ряд металів склав Д.І.Менделєєв “-” Перевірка Кислоти взаємодіють з усіма металами за звичайних умов. “-” 2. Сульфатна кислота є безоксигеновою. “-” 3. При взаємодії кислот з металами утворюється газ водень. “+” 4. Щоб розпізнати серед речовин кислоту, досить скуштувати її на смак. “-” 5. Ортофосфатна кислота – це тверда кристалічна речовина. “+” 6. Усі кислоти добре розчинні у воді. “-”
Чи відповіли ми на запитання,які поставили на початку уроку? Що спільного й чим відрізняються кислоти за фізичними та хімічними властивостями? Що таке індикатор? Як з`ясувати, в якій із пробірок без етикеток міститься вода, а в якій – кислота? Які хімічні властивості характерні для кислот? Чи всі метали взаємодіють з кислотами? Що таке реакції обміну та заміщення? Хто склав витискувальний ряд металів і як ним користуватися?


про публікацію авторської розробки
Додати розробку