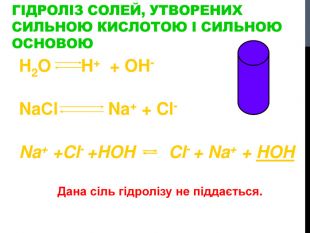
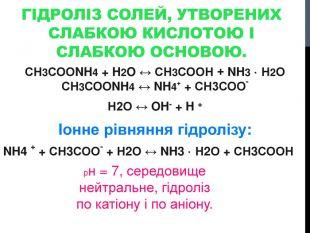
Презентація "Гідроліз солей"
Про матеріал
Презентація до уроку хімії в 11 класі на тему "Гідроліз солей" (рівень стандарту) Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
-
дякую!
-
Дякую.
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку


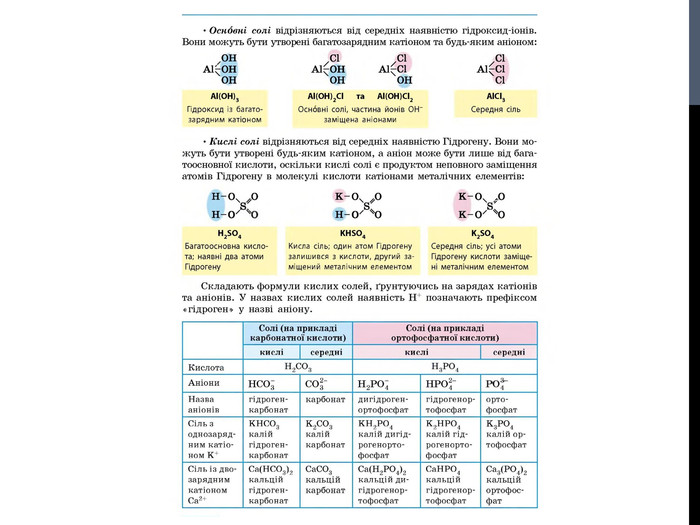
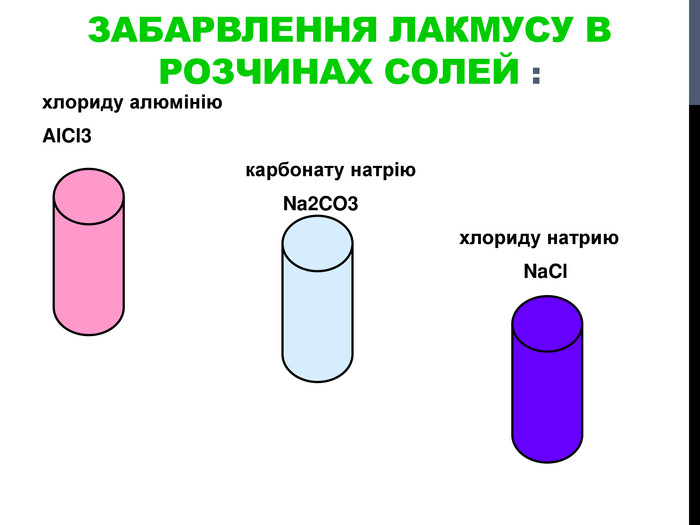

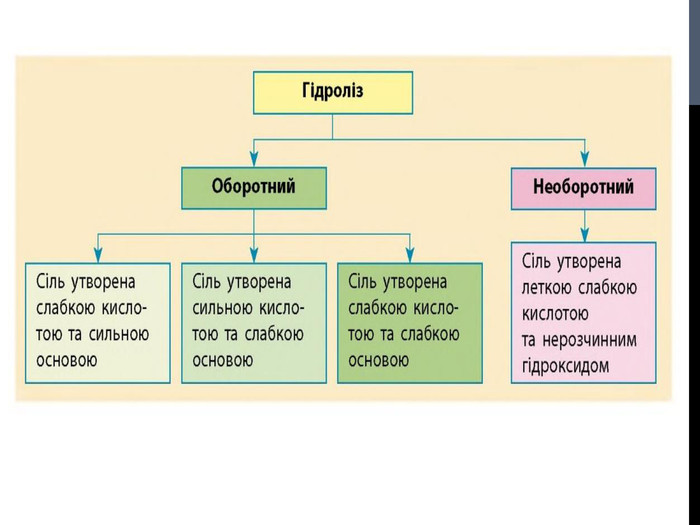
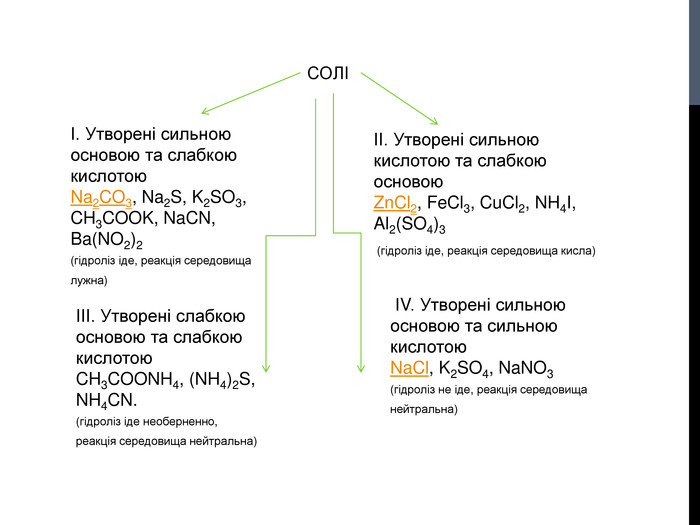
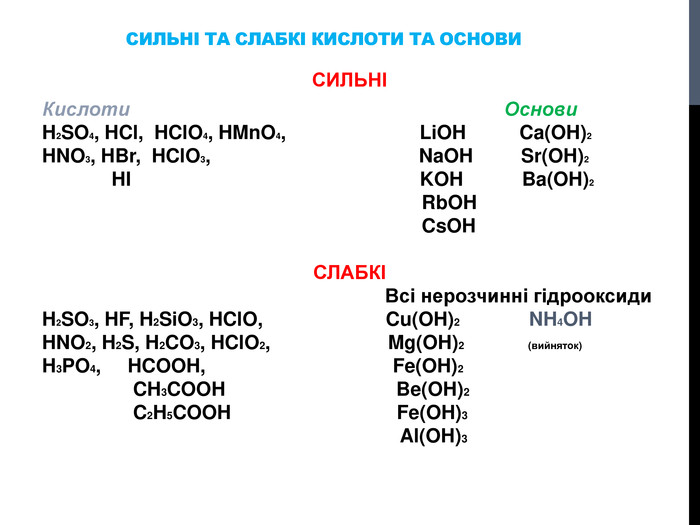
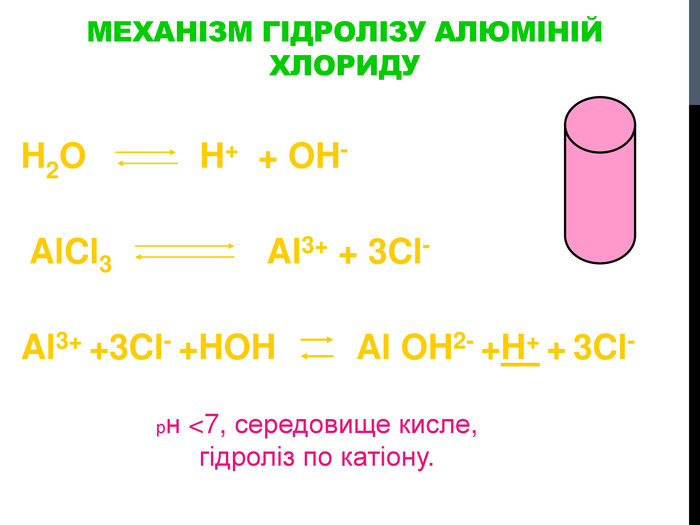
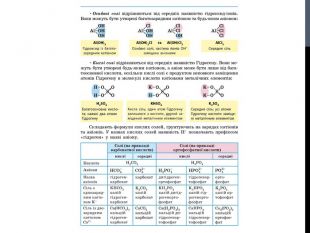
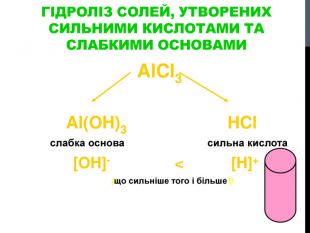
![Гідроліз солей, утворених сильними кислотами та слабкими основами Al. Cl3 Al(OH)3 HCl слабка основа сильна кислота [OH]- < [H]+ (що сильніше того і більше!) Гідроліз солей, утворених сильними кислотами та слабкими основами Al. Cl3 Al(OH)3 HCl слабка основа сильна кислота [OH]- < [H]+ (що сильніше того і більше!)](/uploads/files/302964/259277/281065_images/8.jpg)