Презентація " Металічний, водневий хімічні звязки"
Про матеріал
Презентація до уроку в 11 класі " Металічний, водневий звязки" (рівень стандарт). Містить тести ЗНО. Перегляд файлу





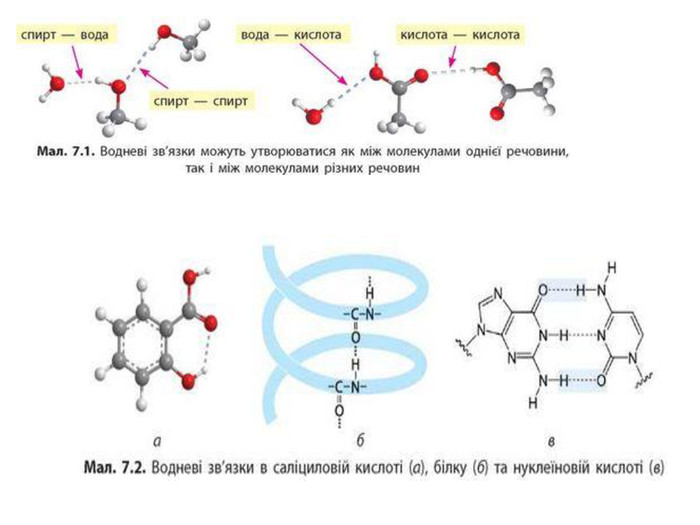
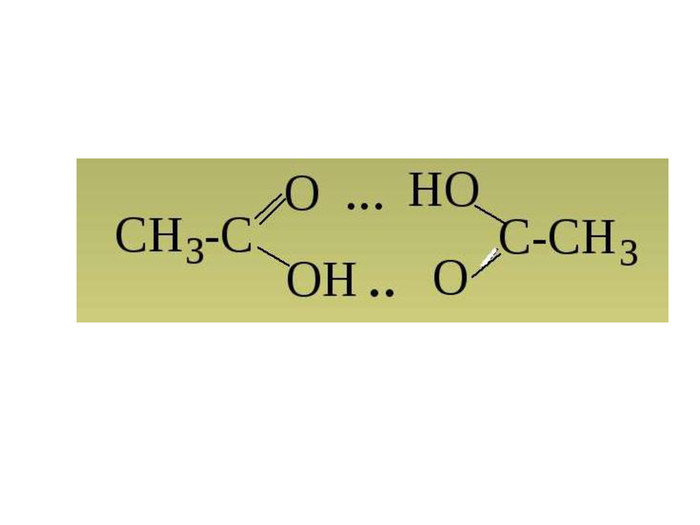


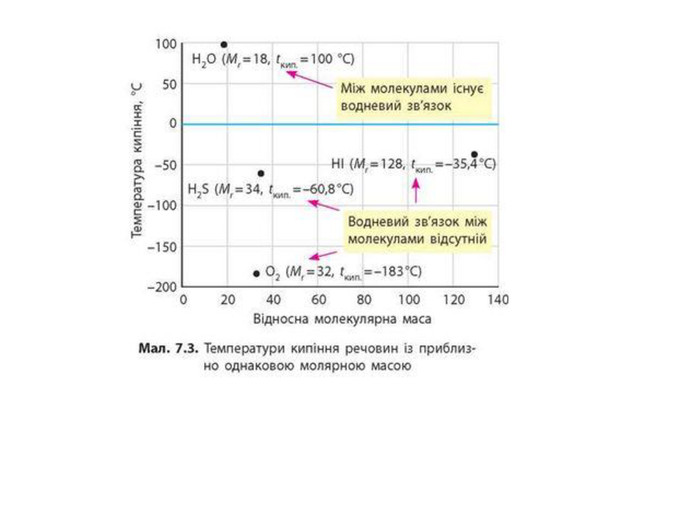
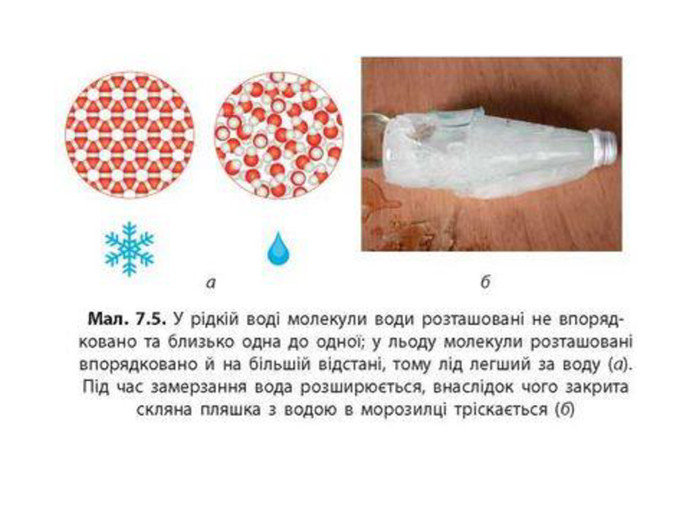































Зміст слайдів
Номер слайду 2
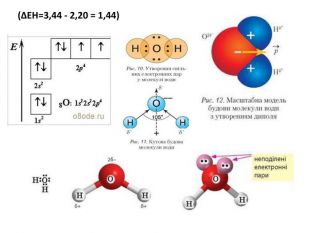
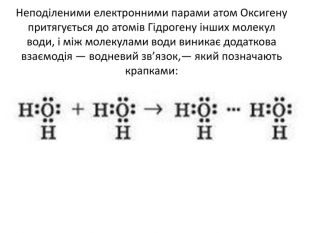
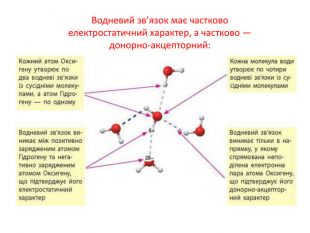
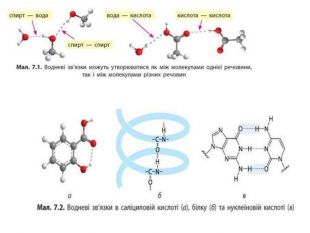
Актуалізація опорних знань: Від чого залежить полярність ковалентного зв'язку? Як визначити, на якому з атомів, сполучених ковалентним зв'язком, з'являється негативний заряд, а на якому — позитивний? Поясність, як за значеннями електронегативностей розрізнити ковалентний неполярний, ковалентний полярний та йонний зв'язки.
Номер слайду 39
Укажіть, до якого елемента зміщені спільні електронні пари в молекулі ССl4 А до Карбону, оскільки його електронегативність вища, ніж у Хлору Б до Карбону, оскільки його електронегативність вища, ніж у Хлору В до Хлору, оскільки його електронегативність нижча, ніж у Карбону Г до Хлору, оскільки його електронегативність вища, ніж у Карбону
Середня оцінка розробки
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Загальна:
5.0
Всього відгуків: 1
Оцінки та відгуки
-
 Оксана Проценко Григорівна 25.09.2022 в 12:41щиро дякуюЗагальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0
Оксана Проценко Григорівна 25.09.2022 в 12:41щиро дякуюЗагальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0
ppt
Додав(-ла)
Медведчук Тетяна
Додано
9 листопада 2021
Переглядів
6619
Оцінка розробки

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку
Рекомендовані матеріали
ppt
18900
4.9
Схожі матеріали