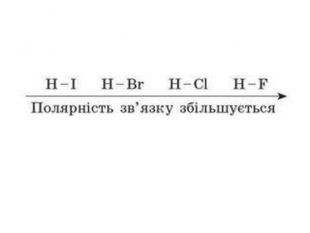Презентація "Ковалентний зв’язок . Донорно-акцепторний механізм утворення ковалентного зв'язку. "



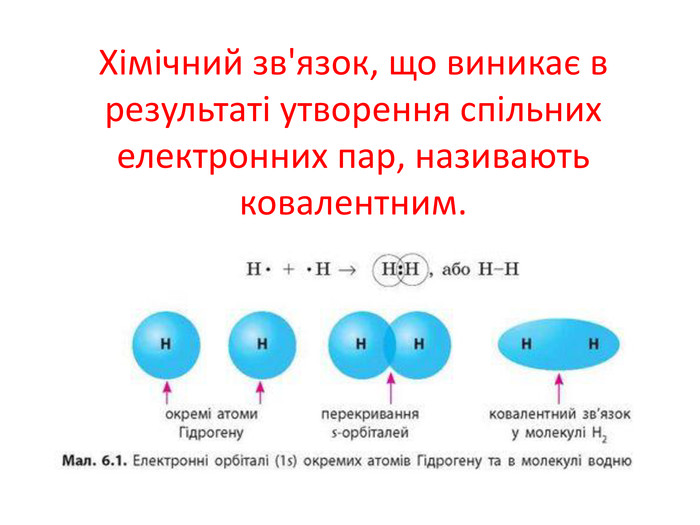
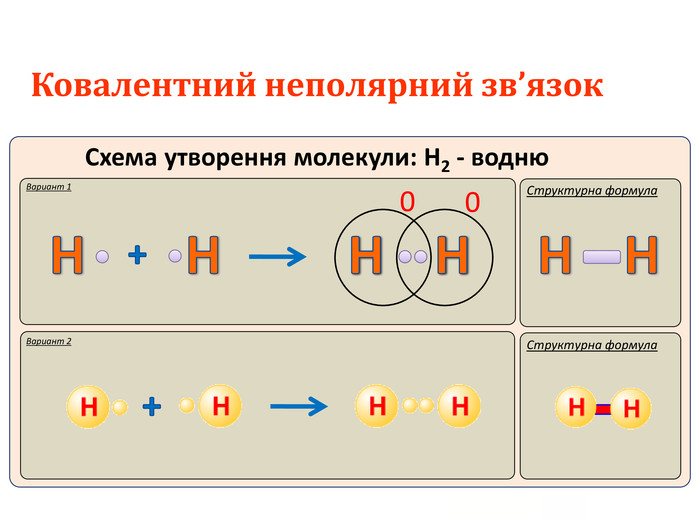
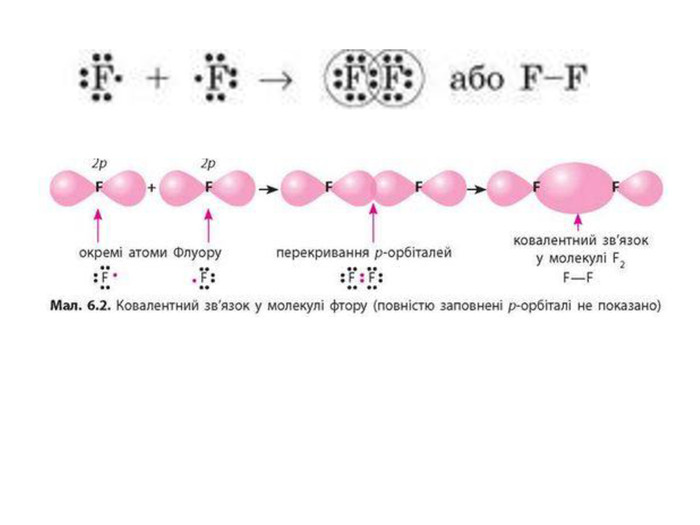
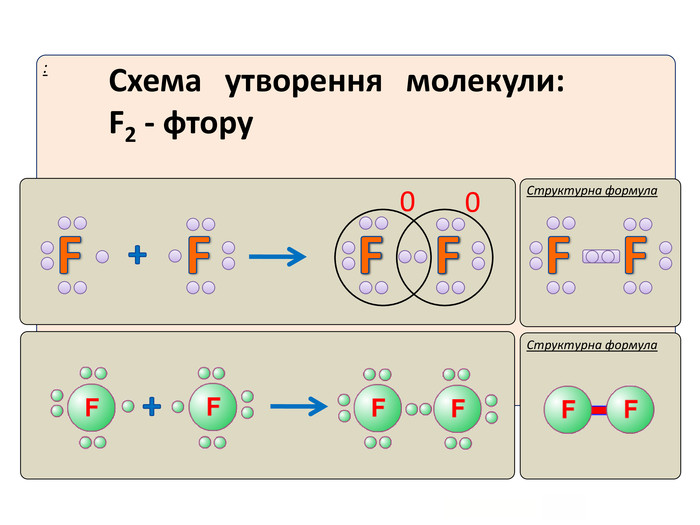
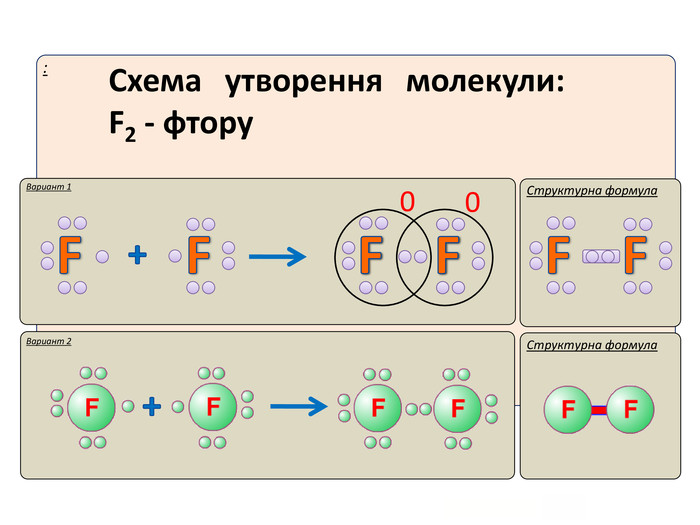
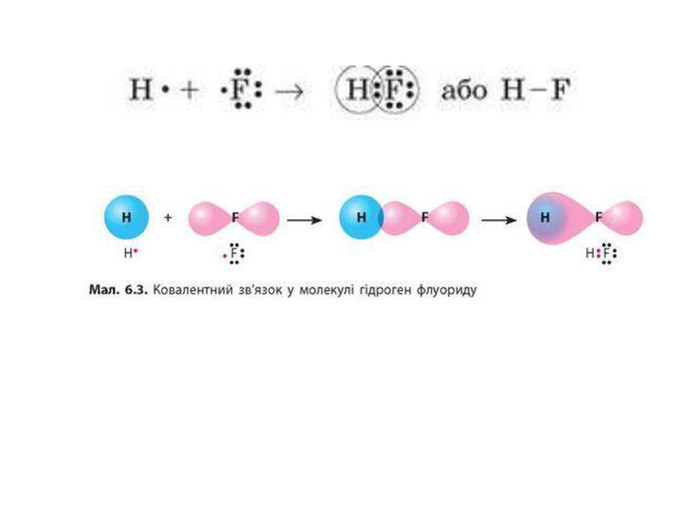



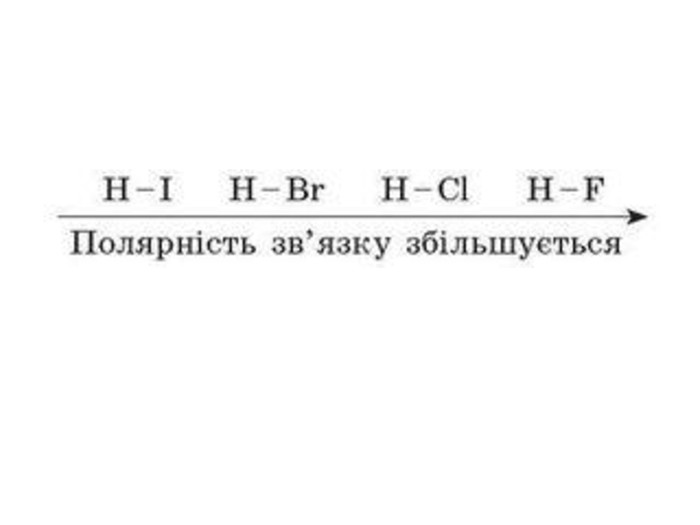































Актуалізація опорних знань: У чому виявляється електронна природа хімічного зв'язку? Схарактеризуйте зміну сумарної енергії двох атомів Гідрогену залежно від відстані між ними. Поясніть причину цих змін. Дайте визначення: а) хімічному зв'язку; б) йонному зв'язку. завдяки яким взаємодіям вони утворюються?
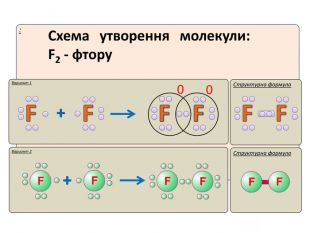
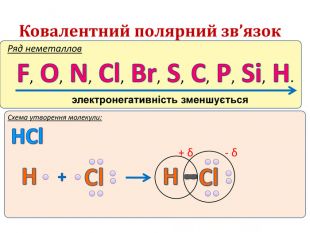
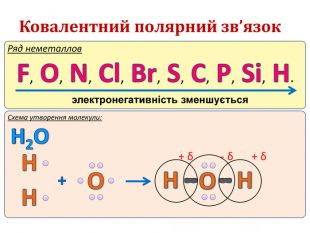
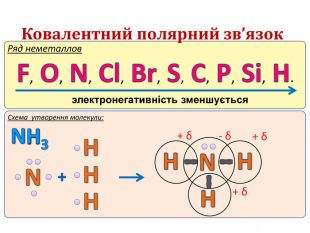
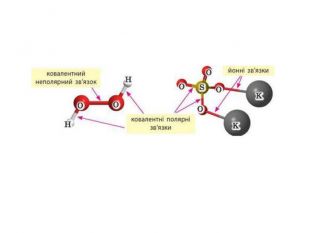
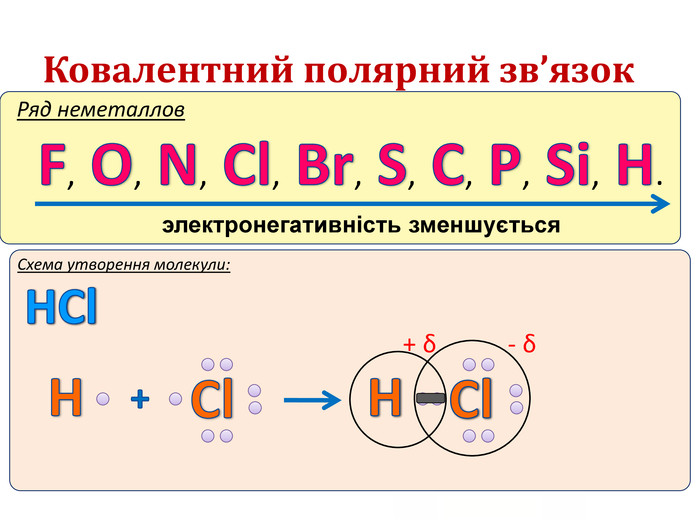
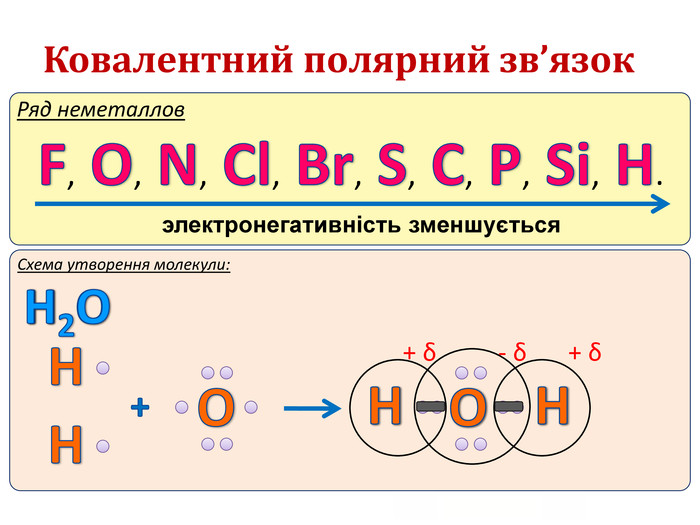
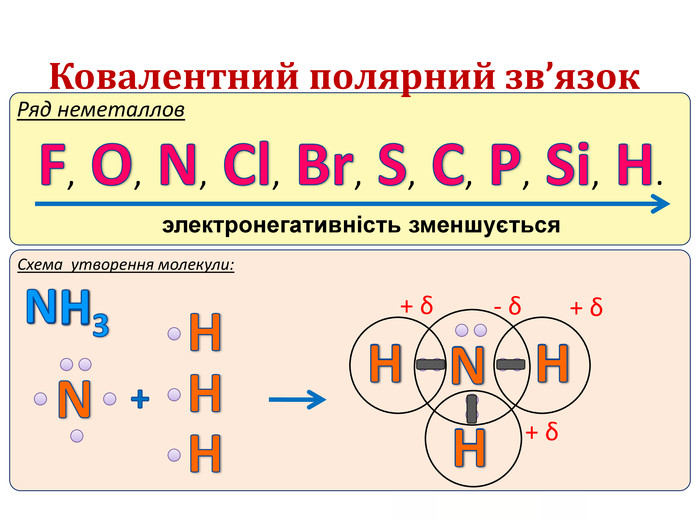
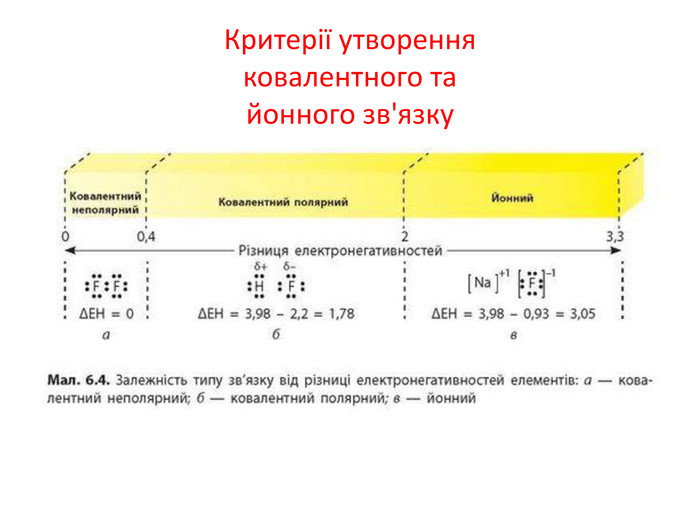
IІ. Ковалентний полярний зв’язок Ряд неметаллов электронегативність зменшується Элемент с большей ЭО, при образовании ковалентной полярной связи, приобретает частично отрицательный заряд (- δ). Далее Элемент з меншою ЕН, при утворенні ковалентного полярного зв’язку, отримує частковий позитивний заряд (+ δ).
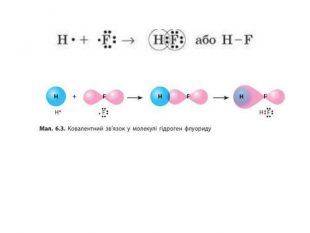
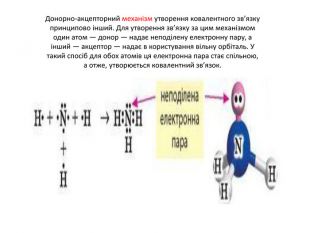
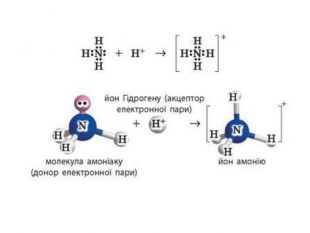
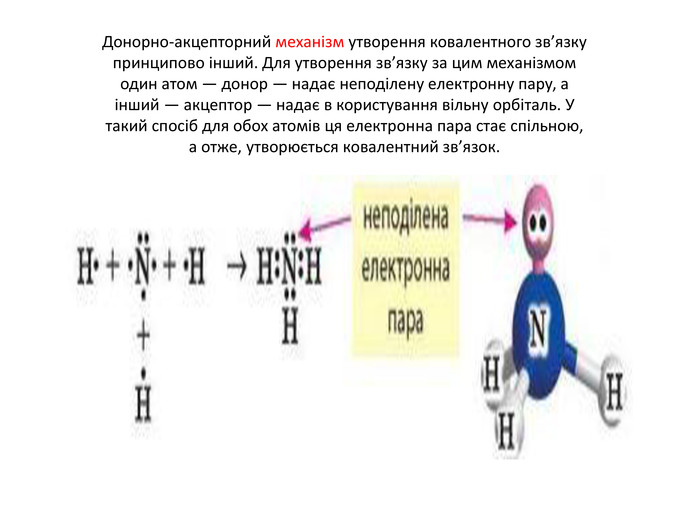
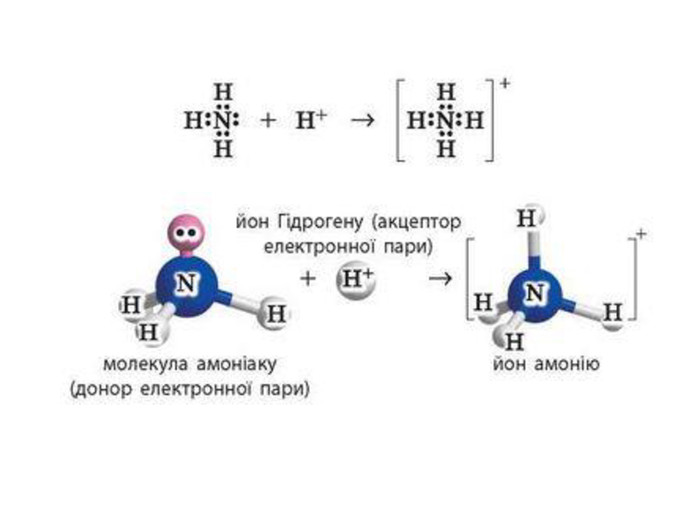
Донорно-акцепторний механізм утворення ковалентного зв’язку принципово інший. Для утворення зв’язку за цим механізмом один атом — донор — надає неподілену електронну пару, а інший — акцептор — надає в користування вільну орбіталь. У такий спосіб для обох атомів ця електронна пара стає спільною, а отже, утворюється ковалентний зв’язок.
Лінгвістична задача Латиною co означає «спільний», а vales — «той, що має силу». Ґрунтуючись на цьому, поясніть зміст терміна «ковалентний». Латиною dono означає «дарую». Що, на вашу думку, є спільного в донора, описаного в цьому параграфі, та в донорів крові чи органів? У латинського слова accipio є аналоги в інших мовах: accept (англ.), accepter (фр.), akzeptieren (нім.). Яке українське слово йому відповідає і чому його використовують для позначення одного з механізмів утворення ковалентного зв'язку?
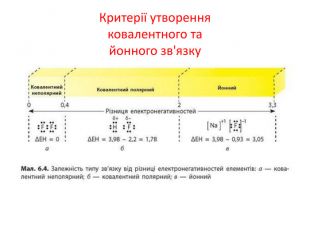
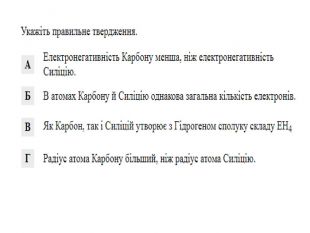
Визначити види з’язків NaСl СF4, N2 NH3, , ССl4, , Н2S, , O2, NаF, ОF2, MgO, SР6, F2. Йонний Ковалентний полярний Ковалентний неполярний Ковалентний полярний Ковалентний полярний Ковалентний полярний Ковалентний неполярний Йонний Ковалентний полярний Йонний Ковалентний полярний Ковалентний неполярний
-
 Грищенко Ирина 01.10.2024 в 12:21дякую!!!Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0
Грищенко Ирина 01.10.2024 в 12:21дякую!!!Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0


про публікацію авторської розробки
Додати розробку