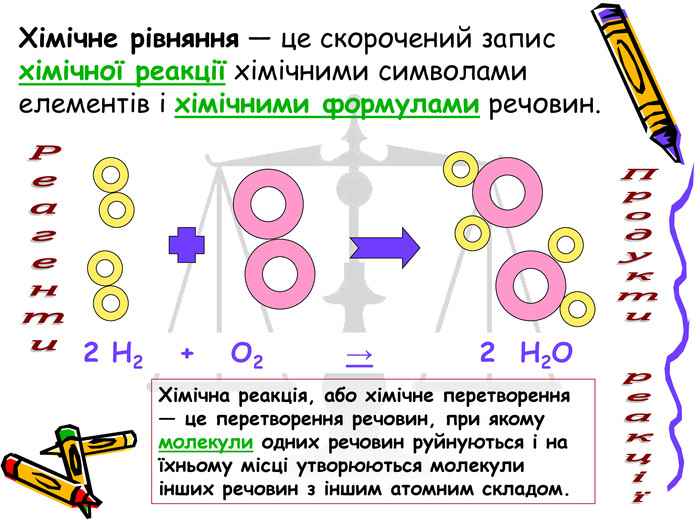
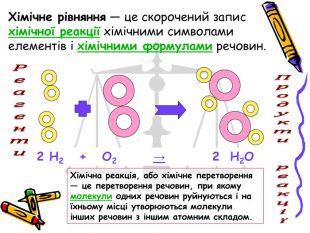
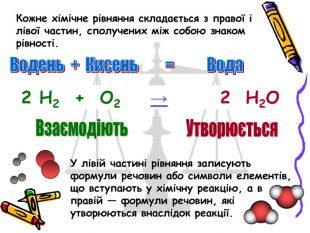
Презентація "Хімічні рівняння"
Про матеріал
Пропонована презентація «додасть кольору» до системного пояснення чи стане в нагоді під час повторення з учнями закономірностей співвідношень та визначень. А, також, містить смислові акценти для можливості реалізації міжпредметних зв'язків.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Чудова презентація. Буду користуватися. Дякую!


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку