Презентація "Хімічні властивості алкенів та алкінів (етену та етину)"

















загальна формула кратні зв'язки тип гібридизації кут між напрямами зв'язку. Алкени. Алкіни. Cn. H2n. Cn. H2n-2 ССССsp2sp1s + 2p = 3sp21s + 1p = 2sp < 120◦< 180◦Ненасичені вуглеводніstyle.colorfillcolorfill.typeppt_xxshearppt_xppt_xxshearppt_xstyle.colorfillcolorfill.typeppt_xxshearppt_xppt_xxshearppt_xstyle.colorfillcolorfill.typeppt_xxshearppt_xppt_xxshearppt_xstyle.colorfillcolorfill.typeppt_xxshearppt_xppt_xxshearppt_x
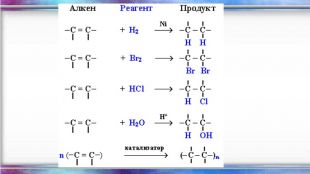
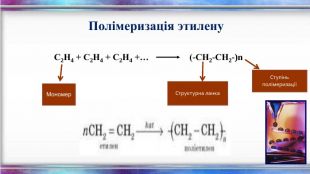
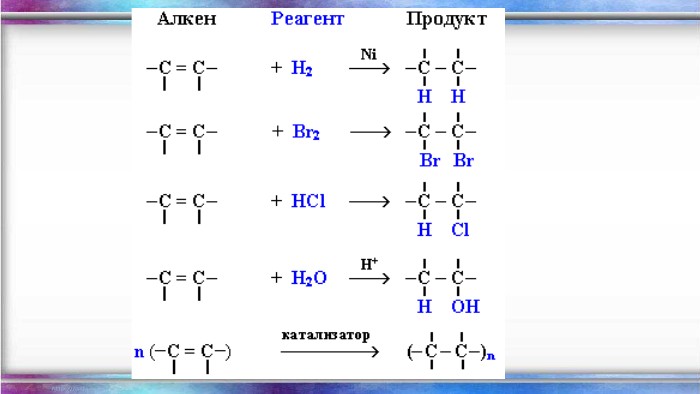
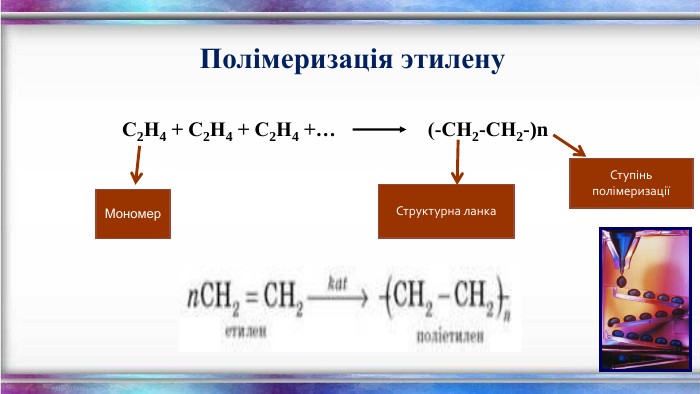
Енергія подвійного зв’язку С=С в молекулі С2 Н4 - 612кдж/моль і є значно нижчою ніж подвоєна енергія простого С–С зв’язку (350·2 = 700кдж/моль). Це означає що Ϭ- та ℼ-зв’язки нерівноцінні. Менш міцним і більш реакційноздатним є ℼ- -зв’язок. Для алкенів характерні реакції приєднання, які відбуваються з розривом ℼ--зв’язку і утворенням двох нових простих - тзв’язків. Характерною особливістю вуглеводнів етиленового ряду є здатність до полімеризації, що веде до утворення високомолекулярних сполук. Алкени вступають також у реакції відновлення та окиснення. Хімічні властивості алкенів
Хімічні властивостіГоріння (з виділенням великої кількості теплоти): С2 Н4 + 3 O2 → 2 СО2 +2 Н2 О2. Реакції приєднання по місцю розривуπ - зв’язку: СН2 = СН2 а) гідрування - приєднання водню: С2 Н4 + Н2→ С2 Н6б) галогенування - приєднання галогенів: С2 Н4 + Br2 →С2 Н4 Br2 Якісне визначення ненасичених вуглеводнів - знебарвлення розчину калій перманганату і бромної водиppt_xxshearppt_xppt_xxshearppt_xppt_xxshearppt_x
Д) Окиснення. У разі окиснення алкенів розведеним розчином калій перманганату утворюються двохатомні спирти — гліколі (реакція Є. Є. Вагнера). Реакція відбувається на холоді: У результаті реакції спостерігається знебарвлення розчину калій перманганату. Реакція Вагнера є якісною пробою на подвійний зв’язок. У процесі жорсткого окиснення алкенів киплячим розчином калій перманганату в кислому середовищі відбувається остаточний розрив подвійного зв’язку й утворення кислот або кетонів.
Застосування. Алкени широко використовуються в промисловості як вихідні речовини для одержання розчинників (спиртів, дихлоретану, естери гліколей тощо), полімерів (поліетилену, полівінілхлориду, поліізобутилену та ін.), а також багатьох інших дуже важливих продуктів. Етилен (етен) H2 C = CH2 використовується для одержання поліетилену, політетрафлуоретилену (тефлону), етилового спирту, оцтового альдегіду, галогенопохідних і багатьох інших органічних сполук.
Основні хімічні властивості алкінів визначаються наявністю у них потрійного зв'язку. Порівняно із алкенами, що мають подвійний зв'язок, алкіни є більш реакційноздатними по відношенню до нуклеофільних реагентів. Так, похідні алкінів (ацетиленіди, меркаптиди) можуть вступати в реакції нуклеофільного приєднання, котрі не властиві для алкенів. Хімічні властивості алкінів
Хімічні властивості ацетилену. Горіння (яскравим кіптявим полум’ям): 2 С2 Н2 + 5 O2 → 4 СО2 +2 Н2 О2. Реакції приєднання по місцю розривуπ - зв’язків відбуваються у дві стадії а) гідрування (каталітичне): С2 Н2 + Н2→ С2 Н4 С2 Н4 + Н2→ С2 Н6 б) галогенування: С2 Н2 + Cl2 → С2 Н2 Cl2 (дихлороетен)С2 Н2 Cl 2 + Cl2 →С2 Н2 Cl4 (дихлороетан)Якісне визначення ненасичених вуглеводнів - знебарвлення бромної води та розчину калій перманганату.style.colorfillcolorfill.typestyle.colorfillcolorfill.typestyle.colorfillcolorfill.typestyle.colorfillcolorfill.typestyle.colorfillcolorfill.typestyle.colorfillcolorfill.type
3. Гідратація (реакція Кучерова)4. Полімеризація. Ацетиленові вуглеводні через наявність потрійного зв’язку схильні до реакцій полімеризації, які можуть відбувається в кількох напрямках: А) *Під впливом комплексних солей Купруму відбувається димеризація і лінійна тримеризація ацетилену. Б) У результаті нагрівання ацетилену в присутності активованого вугілля (реакція Зелінського) відбувається циклічна тримеризація з утворенням бензену.
5. Кислотні властивості ацетилену. Атоми Гідрогену в ацетилені здатні заміщатися металами з утворенням ацетиленідів. Так, унаслідок дії на ацетилен металевого натрію утворюється натрій ацетиленід. Ацетиленіди Арґентуму й Купруму одержують взаємодією з амоніаковими розчинами відповідно арґентум оксиду й купрум хлориду. Ацетиленіди Арґентуму й Купруму виокремлюються надзвичайною вибуховістю. Вони легко розкладаються внаслідок дії хлоридної кислоти.
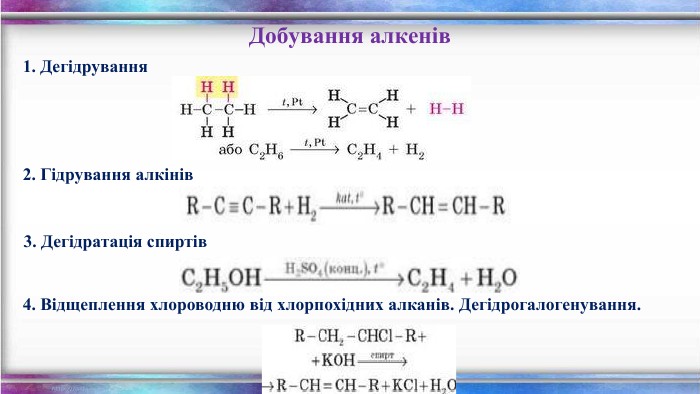
Карбідний метод Даний метод добування ацетилену започаткований Ф. Велером. Кальцій карбід отримують шляхом спікання вапняку з коксом в електропечах при температурі 2000 °СCa. CO3 → Ca. O + CO2 Cа. О + 3 C → Ca. C2 + COПри дії на отриманий карбід води утворюється натрій гідроксид і ацетилен. Ca. С2 + 2 H2 O → Ca(OH)2 + C2 H2 За карбіду магнію Mg3 C2 аналогічно утворюється пропін. Mg3 C2 + 4 H2 O → CH3–C≡CH + 2 Mg(OH)2 Добування алкінів. Дегідрування алкенів та алканів
Піроліз вуглеводнів. Ацетилен добувають піролізом метану при високій температурі в 1200-1500 °С з наступним швидким охолодженням продуктів реакції. Продукти, отримані в результаті реакції піролізу метану, швидко охолоджуються до температури 90-200 °С. Робиться це для того, щоб зберегти ацетилен, оскільки при такій температурі реакція його розкладу припиняється2 CH4 → HC≡CH + 3 H2 У промисловості також використовують теромоокислювальний піроліз метану. Цей процес полягає в неповному згорянні суміші метану з киснем при температурі 1450-1500 °С і атмосферному тиску. Метан який не прореагував при цій температурі розкладається з утворенням ацетилену і ряду інших продуктів6 CH4 + 4 O2 → HC≡CH + CO2 + 3 CO + 8 H2 + 3 H2 OТакож ацетилен добувають піролізом вуглеводневої сировини (бензину, гасу) при 1200-1500 °С, який проходить легше ніж піроліз метану. C6 H14 → 3 HC≡CH + 4 H2 Добування алкінів
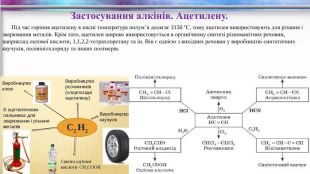
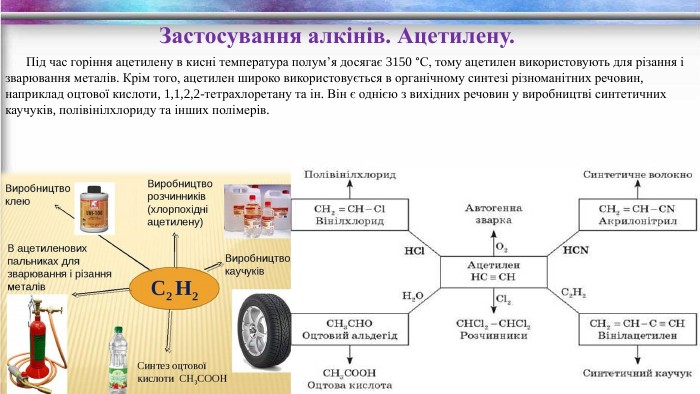
Застосування алкінів. Ацетилену. Під час горіння ацетилену в кисні температура полум’я досягає 3150 °С, тому ацетилен використовують для різання і зварювання металів. Крім того, ацетилен широко використовується в органічному синтезі різноманітних речовин, наприклад оцтової кислоти, 1,1,2,2-тетрахлоретану та ін. Він є однією з вихідних речовин у виробництві синтетичних каучуків, полівінілхлориду та інших полімерів.
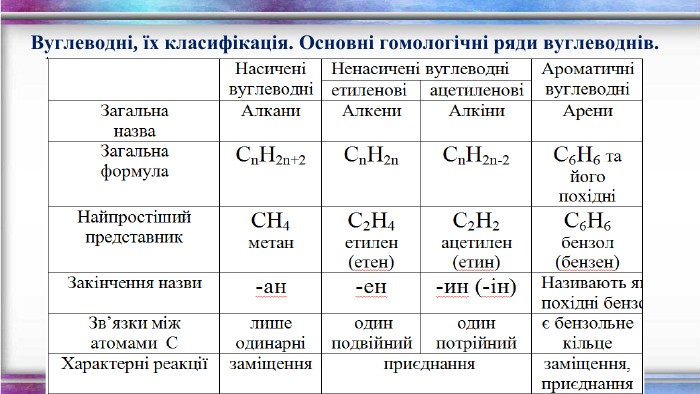
Порівняльна таблиця {5 DA37 D80-6434-44 D0-A028-1 B22 A696006 F}№ п/п. Назва. Клас вуглеводню. Загальна формула. Будова. Хімічні властивостіЯкісне визначення1. СН4метан. Насичені,алкани. Сn. H2n+2 тетраедродинарні зв’язки. Реакції заміщення: СН4 +Cl 2→СН3 Cl+НCl. Горіння: СН4 +2 O2 →СО2+2 Н2 ОСтійкі до дії розчинів бромної води та калій перманганату2. С2 Н4 етен. Етиленові,алкени. Сn. H2n С=Сподвійний зв’язок. Реакції приєднання, полімеризації : С2 Н4 + Br2 → С2 Н4 Br2 n. С2 Н4 → (- С2 Н4 -)n Знебарвлення розчину бромної води і калій перманганату3. С2 Н2етин. Ацетиленові,алкіни. Сn. H2n-2 С ≡ С потрійнийзв’язок. Реакції приєднання (дві стадії): С2 Н2 + Н2 → С2 Н4 С2 Н4 + Н2 → С2 Н6 Знебарвлення розчину бромної води і калій перманганату
Задача 1. У результаті згоряння вуглеводню масою 5,6 г утворилося 8,96 л карбон(IV) оксиду (н. у.) і 7,2 г води. Відносна густина цього вуглеводню за воднем дорівнює 14. Визначте формулу вуглеводню. Закріплення. Задача 2. У результаті згоряння вуглеводню масою 6,5 г утворилося 11,2 л карбон(IV) оксиду (н. у.) і 4,5 г води. Відносна густина вуглеводню за воднем дорівнює 13. Визначте формулу вуглеводню.


про публікацію авторської розробки
Додати розробку