Презентація "Хімічні властивості кислот. Розв'язування задач за рівняннями хімічних реакцій"
Про матеріал
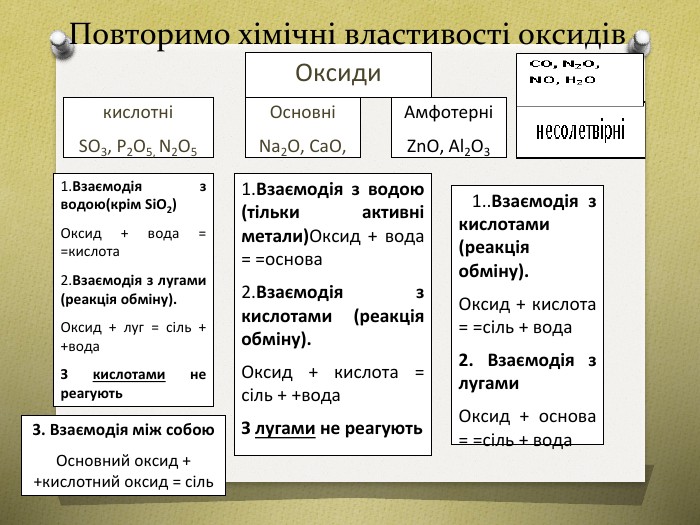
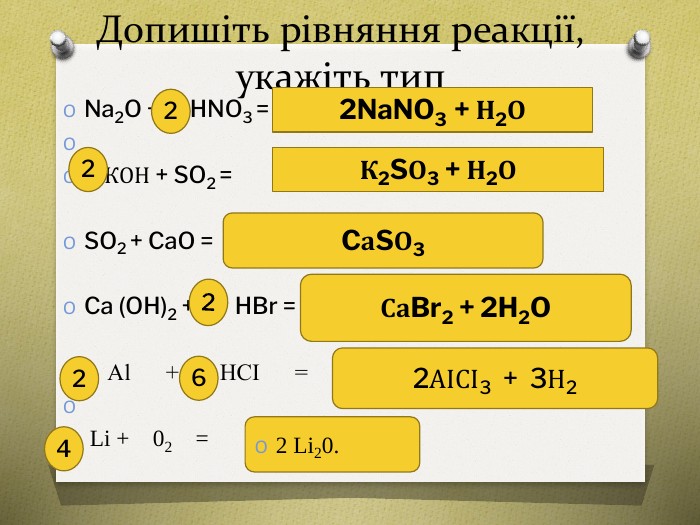
Урок узагальнення знань з теми "Оксиди.Кислоти. Розв'язування задач за рівнянням реакції". Підійде для використання при дистанційному навчанні та містить матеріал по підготовці до контрольного тестування учнів з теми. Контрольний тест розміщено на сайті у розділі "Тести"
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку