Презентація "Хімічні властивості кисню. Взаємодія з простими речовинами"
Про матеріал
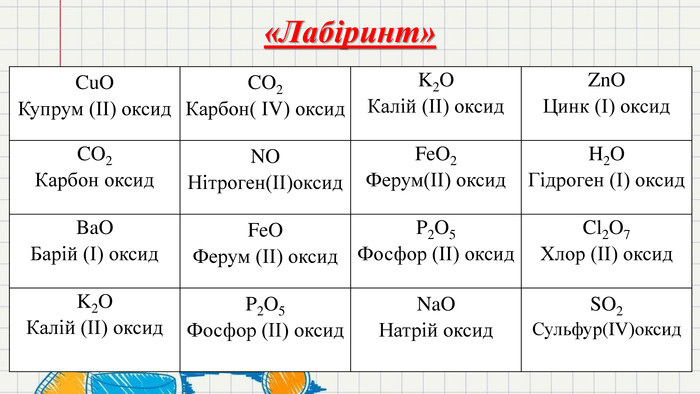
Презентація до уроку Хімічні властивості кисню та взаємодія з простими речовинами. Наявні завдання для узагальнення та систематизації знань в ігрофій формі. До даної презентації наявний конспект уроку на тему Хімічні властивості кисню та взаємодія з простими речовинами.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
-
-
щиро дякую!
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку