Презентація "Хімічний зв'язок"
Про матеріал
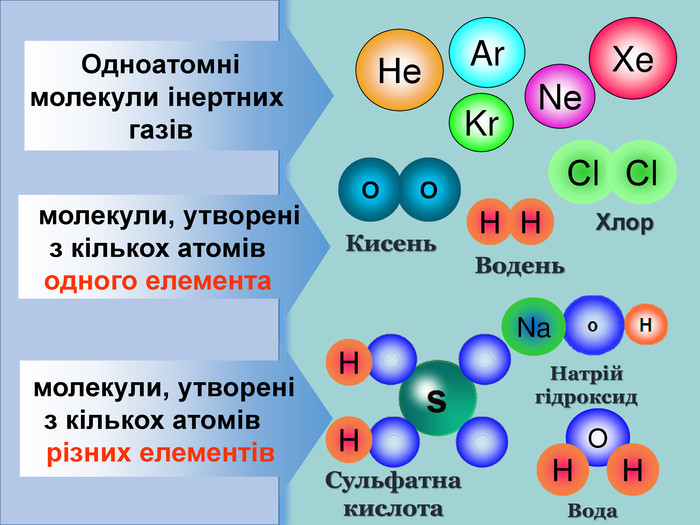
Тема: Природа хімічного зв’язку. Електронегативність атомів хімічних елементів.
Мета:
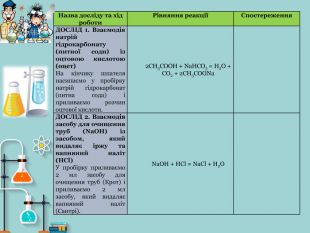
1) освітня – ознайомити учнів із причинами виникнення хімічного зв'язку між атомами в процесі утворення простих і складних речовин;
2) виховна – виховувати пізнавальний інтерес до предмета;
3) розвиваюча – розвивати мислення учнів, вміння робити висновки; підвищувати творчу активність учнів; сприяти розвитку інтересу до вивчення предмета.
Завдання:
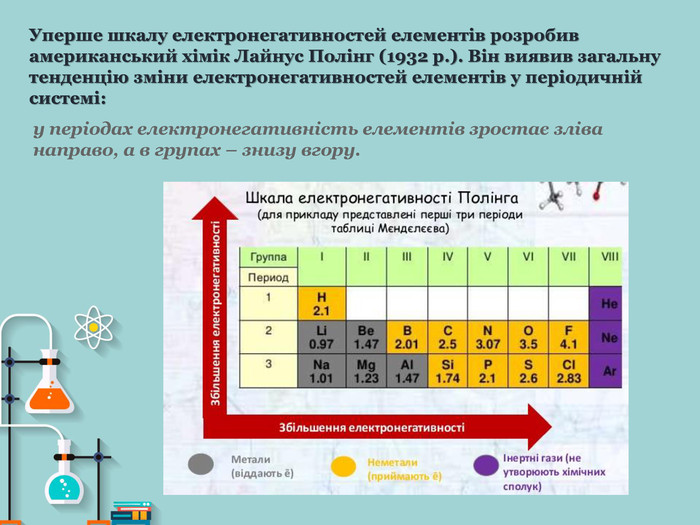
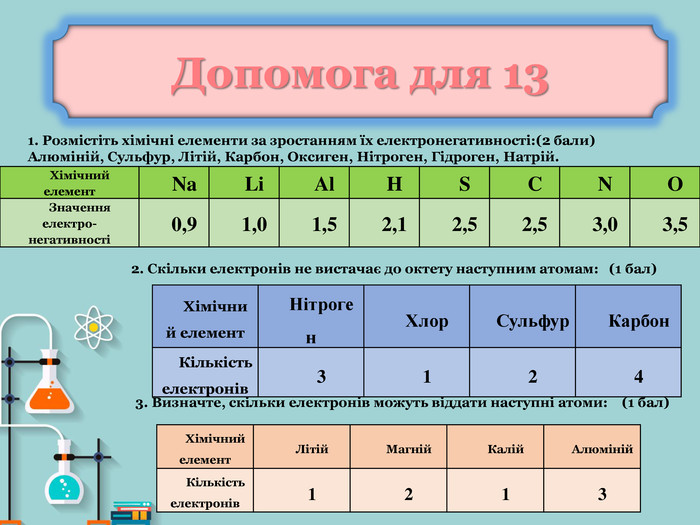
1) розкрити зміст поняття електронегативність;
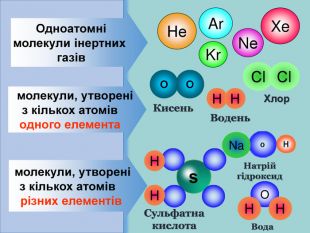
2) поглибити знання про періодичний закон і будову атома на прикладі утворення хімічного зв'язку між атомами різних хімічних елементів.
Тип уроку: засвоєння нових знань.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
дякую
-


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку