Конспект уроку з хімії для 8 класу "Поняття про лужні, інертні елементи, галогени."
[Введите текст]
8 клас Урок № 5.Тема. Поняття про лужні, інертні елементи, галогени.
Мета:
навчальна: розширити знання про хімічні елементи та їх властивості на прикладі родин хімічних елементів : лужних металів, галогенів, інертних елементів. Розкрити залежність властивостей елементів від порядкового номера елементів.
розвиваюча: розвивати пізнавальний інтерес, увагу, логічне мислення, вміння самостійно робити висновки та оцінювати свою роботу на уроці, розвивати предметну, комунікативну, полікультурну компетентність.
виховна: розвивати пізнавальні інтереси учнів; сприяти формуванню в учнів уявлень про зв’язок теорії з практикою;
Тип уроку:
- комбінований урок засвоєння знань, умінь і навичок та їх творчого застосування на практиці.
Форми роботи:
- евристична бесіда , фронтальна робота з класом, робота з текстом підручника та таблицями..
Обладнання: мультимедійна презентація, періодична система хімічних елементів, таблиця розчинності, ряд активності металів, ніж, зразки лужних металів (Li, Na), галогенів (I2, Br2), спиртовий розчин йоду, склянка з водою, фенолфталеїн.
Хід уроку
І. Актуалізація опорних знань.
1. Пригадайте, які були перші спроби класифікації хімічних елементів?
2. Які класифікації хімічних елементів ми використовували на попередніх уроках?
ІІ. Мотивація навчальної діяльності.
Здавна було помічено, що властивості деяких елементів, а також простих речовин та їх сполук, подібні. Такі елементи об’єднали в родини. Розглянемо три найважливіші родини; лужні метали, галогени і інертні елементи.
ІІІ. Вивчення нового матеріалу
Родина лужних металів
- Прослухайте кілька рядків вірша, прокоментуйте його зміст:
Ось родина в першій групі
Є у головній підгрупі.
Це метали надактивні,
Інколи аж дуже дивні.
У воді іскру пускають,
Вони – лужні, всі це знають.
- А зараз дамо характеристику лужних металів.
1. До лужних металів належать Li, Na, К, Rb, Cs, Fr (Францій - це штучний, дуже радіоактивний метал). Розташовані у 1 групі головній підгрупі.
Валентність лужних металів – І
2. Фізичні властивості лужних металів
Робота з текстом підручника, таблицею на екрані (презентація), демонстрація натрію і літію.
- Мають металевий блиск, сріблясто-білі (за виключенням цезію - метал золотистого кольору з сріблястим блиском)
- М’які, легко ріжуться ножем.
- Пластичні.
- Легкоплавкі.
- Легкі, мають невелику густину (легші за воду).
- Добре проводять тепло і електричний струм.
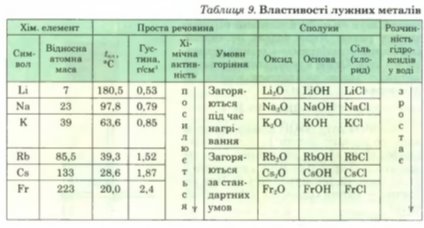 У ряді Li, Na, К, Rb, Cs, Fr tкип ° tплавл ° зменшуються (зі збільшенням атомної маси), густина збільшується.
У ряді Li, Na, К, Rb, Cs, Fr tкип ° tплавл ° зменшуються (зі збільшенням атомної маси), густина збільшується.
|
Характеристики |
Літій |
Натрій |
Калій |
Рубідій |
Цезій |
Францій |
|
Символ |
Li |
Na |
К |
Rb |
Cs |
Fr |
|
Атомна маса |
6,94 |
22,99 |
39,10 |
85,47 |
132,91 |
[223] |
|
Порядковий номер |
3 |
11 |
19 |
37 |
55 |
87 |
|
Валентність |
І |
І |
І |
І |
І |
І |
|
Радіус атома, нм |
0,156 |
0,192 |
0,238 |
0,251 |
0,271 |
|
|
Густина, г/см3 |
0,53 |
0,97 |
0,86 |
1,52 |
1,87 |
|
|
Температура плавлення, °С |
179 |
97,8 |
6305 |
39 |
28,5 |
|
|
Температура кипіння, °С |
1 340 |
883 |
760 |
696 |
708 |
|
|
Агрегатний стан (Н. у.) |
Твердий |
Твердий |
Твердий |
Твердий |
Твердий |
Твердий |
|
Колір полум’я |
Червоно-коричневий |
Жовтий |
Фіолетовий |
Червоний |
Фіолетовий |
|
3. Хімічні властивості лужних металів.
Лужні метали дуже активні, вони легко реагують з киснем повітря, водою, тому зберігаються в банках з гасом або запаяних ампулах (демонстрація).
1.Лужні метали активно реагують з киснем.
Li, Na, К загоряються на повітрі лише за нагрівання, а метали з більшою атомною масою без нагрівання.
Спробуйте прокоментувати подію, яка сталася у Цюріху перед лекцією професора Вельта.
Один зі студентів взяв із виставленої банки шматок калію і, ретельно загорнувши в носовичок, поклав до кишені. Під час лекцій калій почав реагувати з вологим повітрям. Студент неспокійно закрутився на лаві, потім раптом схопився на неї і стрімко вирвав кишеню, яка запалала, разом з її вмістом. У чому справа? – Вигукнув переляканий професор. У мене в кишені був шматочок калію, загорнутий в ганчірочку, відповів тремтячий від страху викрадач. Студенти почали голосно сміятись! Студент постраждав не тільки від глузувань, а й від опіків. Залишки кишені як застереження увійшли в хімічну колекцію кафедри і зберігалися в банці з написом: «Дія вкраденого калію на кишеню студентських брюк».
Запитання :
- В чому мораль цієї історії?
- Чому студент отримав опіки?
Запишемо рівняння реакцій, що відбуваються при взаємодії метала з киснем:
4Li + O2 = 2Li2O
4Na + O2 = 2Na2O
2. Лужні метали активно реагують з водою. (демонстрація)
Прослухайте ще одну історію, дайте відповідь на питання:
Англійський хімік Г. Деві під час електролізу лугу КОН відкрив новий елемент, калій. Деві кинув калій у воду й очікував, що метал має негайно опуститися на дно. Але калій повівся інакше. З гучним шипінням цей метал забігав по поверхні води. Потім пролунав оглушливий вибух, і спалахнуло полум’я. Так він і носився по воді, поки не перетворився на їдкий луг.
Запитання :
- Чому метал не потонув у воді?
- Як можна довести, що в результаті реакції утворився луг? (фенолфталеїн набуває малинового кольору, лакмус – синього)
Запишемо рівняння реакцій, що відбуваються при взаємодії метала з киснем:
2Li + 2Н2О = 2LiOН + Н2↑
2Na + 2Н2О = 2NaOН + Н2↑
2K + 2Н2О = 2КOН + Н2↑
З водою літій реагує повільно, натрій значно швидше, а калій дуже швидко й виділяє стільки тепла, що водень, виділяючись, загоряється.
Родина галогенів
- Прослухайте кілька рядків вірша, прокоментуйте його зміст:
В сьомій групі – галогени,
Ніби справжні джентльмени.
Люблять завжди в парі бути –
Це їх звичні атрибути.
З Гідрогеном дуже дружать
І тоді кислотам служать.
- А зараз дамо характеристику галогенів.
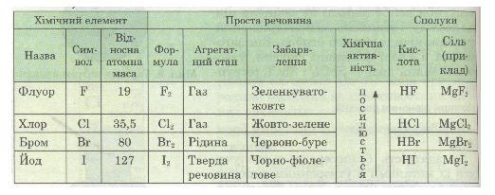
1. До галогенів належать F, Cl, Br, I, At
- Галогени — типові неметали, у періодичній системі розташовані в VII групі головної підгрупи, їх назва походить від слів галос — «сіль» і ген — «той, що народжує».
- Усі прості речовини галогенів – двохатомні молекули: F2, Cl2, Br2, І2, Аt2
(астат нестабільні темно-сині кристали, радіоактивний, самий рідкісний із всіх елементів, що зустрічаються не Землі)
( демонстрація ампули з бромом, кристалів йоду)
Теннессін (Ts) - елемент№117 був відкритий практично нещодавно. Комісія IUPAC офіційно визнала відкриття цього елемента 30 грудня 2015 року. Його властивості ще є предметом численних суперечок.
2. Фізичні властивості галогенів
Робота з текстом підручника, таблицею на екрані (презентація), демонстрація
Хлор хвалился: «Нет мне равных!
Галоген я самий главный.
Зря болтать я не люблю:
Все на свете отбелю!»
Йод красой своей гордился,
Твердым был, но испарился.
Фиолетовый как ночь,
Далеко умчался прочь.
Бром разлился океаном,
Хоть зловонным, но румяным.
Бил себя он грозно в грудь:
«Я ведь бром! Не кто – нибудь!..»
Фтор молчал и думал:
«Эх!..Ведь прийду – окислю всех…»
3. Хімічні властивості галогенів
Галогени є найактивнішими неметалами. Їх активність зростає у ряду І→Br→Cl→F.
- Галогени активно реагують з металами, утворюючі солі.
2Na + Cl2 = 2NaCl
Zn + I2 = ZnI2
2Al + 3Br2 = 2AlBr3
- Галогени активно реагують з воднем.
H2 + F2 = 2HF
H2 + Cl2 = 2HCl
H2 + Br2 = 2HBr
H2 + I2 = 2HI
4. Повідомлення учнів про галогени
Фтор — газ ясно-зеленого кольору, дуже отруйний. Багато вчених, які працюють із ним, постраждали від цього. Це найбільш активний неметал (у флуорі навіть вода горить). Фтор дуже корисний для зубів, саме тому його додають в зубні пасти. Застосування лікувальних і профілактичних засобів, у складі яких присутній хімічний елемент фтор, запобігає появі карієсу.
Хлор - важкий газ жовто - зеленого кольору з різким запахом, отруйний, використовувався у Першу світову війну, як хімічна зброя.
Хлор використовують для отримання хлоридної кислоти, яка незамінна в промисловості та медицині. Хлор використовують для виготовлення каучуку, пластмаси, розчинників, барвників, а також синтетичних волокон. Сполуки хлору використовують у сільському господарстві для боротьби з шкідниками. Хлор використовують також для відбілювання паперу і тканин.
Бром – важка темно-коричнева рідина, дуже активний неметал, але менш активний, ніж хлор. Бром має надзвичайно неприємний запах (з грецької «бром» так і перекладається – «смердючий»). Сполуки брому часто використовують у медицині.
Йод — темно-фіолетові кристал з блиском, активний неметал, найменш активний у ряді галогенів. Його спиртовий розчин використовують у медицині. А відкрити йод допоміг звичайнісінький кіт. Це сталося у 1811 році. У французького хіміка-технолога і фармацевта Бернара Куртуа був улюблений кіт, який полюбляв сидіти на плечах хазяїна. Одного разу кіт, чогось злякавшись, стрибнув на підлогу, але потрапив на пляшки, що стояли близько лабораторного столу. Він перевернув склянку із сульфатною кислотою на попіл з морських водоростей. Відразу з'явилася клуби фіолетового пара, які осідали на навколишні предмети у вигляді найдрібніших чорно-фіолетових кристалів з металевим блиском і їдким запахом. Це був йод.
Родина інертних елементів (благородних газів)
- Прослухайте кілька рядків вірша, прокоментуйте його зміст:
Що за горді, наче ружі,
І до всіх завжди байдужі,
Елементи в восьмій групі
Є у головній підгрупі?
Це спокійні, благородні
Гази, що з усіма згодні,
В поведінці неактивні,
У житті вони пасивні.
В назві їх ці всі моменти,
Це – інертні елементи.
1. Інертні елементи — це елементи головної підгрупи VIII групи періодичної системи: Не, Ne, Аr, Кr, Хе, Rn
Гелій, Неон, Аргон, Криптон, Ксенон, Радон, і, відкритий нещодавно, у 2002 р. Оганесон (№118).
Прості речовини цих елементів – одноатомні гази, що не мають запаху і кольору. Особливим є Оганесон, який при нормальних умовах є твердою речовиною. Він та радон є радіоактивними.
.
2. Повідомлення учнів про інертні гази
Гелій - займає друге місце за поширеністю у Всесвіті після водню). Проте на Землі гелій є рідкісним елементом.
У 1868 році француз Жансе й англієць Лок'єр під час вивчення сонячних протуберанців відкрили спектр нового хімічного елемента, що не належав жодному з відомих на земній кулі. «Небесний» елемент назвали Гелієм.
Незабаром Гелій був виявлений і на Землі. Гелій виявився найлегшим після водню газом. Легкість і негорючість гелію використовують для заповнення ним повітряних куль і дирижаблів.
Суміш гелію з киснем застосовують для дихання під час підводних робіт.
Неон відкрили у 1898 році.
Якщо крізь розріджені інертні гази пропускати електричний струм, то вони випромінюють світло різного забарвлення. тому їх використовують для світлових реклам і в маяках. Неоном наповнюють трубки для світлових реклам, при цьому вони світяться оранжево-червоним.
Аргон У 1894р Релей виявив у звичайному повітрі домішок, який не вступав у хімічні реакції. Цей елемент назвали Аргон («ледачий»). Ця назва підкреслює найважливішу властивість елемента – його хімічну неактивність.
Аргон, зважаючи на свою неактивність і низьку теплопровідність, використовується в суміші з азотом для наповнення електричних ламп. Аргоном наповнюють трубки для світлових реклам, при цьому вони світяться блакитним кольором. В інертному середовищі аргону здійснюють електрозварювання металів, що легко окислюються.
Криптон 1895 році шотландський хімік Вільям Рамзай , намагаючись виділити з одного із мінералів аргон, отримав натомість інертний газ, спектр якого не був схожий на відомі йому атмосферні гази. Рамзай назвав газ криптон, від грец. κρυπτός — прихований, захований.
Ксенон - відкрито у 1898 році англійськими вченими як домішка до криптону. Ксенон означає “чужий”. Застосовують в електровакумних приладах, раніше – в газосвітних лампах.
Радон- будучи важким газом, з часом накопичується у закинутих підвальних приміщеннях без вентиляції. Саме тому не рекомендується тривалий час там знаходитись.
ІV. Закріплення набутих знань . Підведення підсумків уроку.
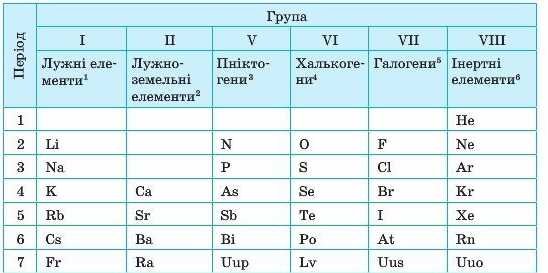
Які родини хімічних елементів ви вивчили?
Але існують і інші родин, з якими ми познайомимося під час вивчення хімії.
Родини хімічних елементів
![]()
V. Домашнє завдання:
Вивчити §
Виконати вправу

про публікацію авторської розробки
Додати розробку
