Урок "Реакції заміщення й обміну. Заходи безпеки під час роботи з кислотами"
8 клас
Тема: Реакції заміщення й обміну. Заходи безпеки під час роботи з кислотами
Мета:
- знаннєвий компонент: учень/учениця називає основи, кислоти за сучасною науковою українською номенклатурою; наводить приклади оксидів, оксигеновмісних і безоксигенових, одно-, дво-, триосновних кислот;
- діяльнісний компонент учень/учениця розрізняє оксиди, кислоти за складом (оксигеновмісні, безоксигенові) та основністю (одно-, дво-, триосновні); реакції заміщення, обміну, нейтралізації; складає хімічні формули оксидів, основ, кислот, середніх солей; рівняння реакцій, які характеризують хімічні властивості кислот; класифікує неорганічні сполуки за класами; характеризує фізичні та хімічні властивості кислот; використовує таблицю розчинності кислот, основ та солей для складання рівнянь хімічних реакцій; індикатори для виявлення кислот і лугів; планує експеримент, проводить його, описує спостереження, робить висновки; прогнозує перебіг хімічних реакцій кислот з металами, використовуючи ряд активності металів; дотримується запобіжних заходів під час роботи з кислотами і лугами.
- ціннісний компонент: учень/учениця обґрунтовує залежність між складом, властивостями та застосуванням неорганічних речовин.
Тип уроку: комбінований.
Методи: інтерактивні методи навчання: робота в парах, гра “Хто більше”, метод “Коректор” та «Ресторан», вправи «Хмаринка» та «Ланцюжок перетворень»
Ключові компетентності: спілкування державною мовою; математична компетентність; основні компетентності у природничих науках і технологіях; уміння вчитися впродовж життя; ініціативність і підприємливість; екологічна грамотність і здорове життя.
Наскрізні змістові лінії: здоров’я та безпека; екологічна безпека і сталий розвиток; підприємливість і фінансова грамотність.
Хід уроку
І. Організаційний момент
ІІ. Мотивація навчальної діяльності
Тема нашого уроку “Кислоти”, а точніше реакції заміщення та обміну, в які вони можуть вступати та заходи безпеки під час роботи з кислотами.
На сьогоднішньому уроці ви повинні дізнатись з якими речовинами взаємодіють кислоти, які реакції належать до реакцій обміну, заміщення; вміти ілюструвати хімічні властивості кислот; вміти користуватися рядом активності металів.
ІІІ. Актуалізація опорних знань
Діти, знання, отримані вами на попередніх уроках, потрібно вміти застосовувати у потрібний момент. І ось зараз ми проведемо гру ….
- Гра «Хто більше» (робота в парах)
 Запишіть та назвіть якомога більше формул кислот із наведеними хімічними елементами. Назвіть їх
Запишіть та назвіть якомога більше формул кислот із наведеними хімічними елементами. Назвіть їх





Із поміж утворених кислот вкажіть оксигеновмісні та безоксигеновмісні
ІV. Вивчення нового матеріалу
Ми з вами повторили назви та класифікацію кислот. Для роботи з кислотами нам необхідно з’ясувати правила техніки безпеки при роботі з кислотами.
Випереджувальне завдання для учнів
(Один із учнів зачитує правила)
- Кислоти відносяться до їдких речовин.
- Не залишайте склянки з кислотами відкритими.
- Забороняється куштувати кислоти на смак.
- При потраплянні на шкіру або слизові оболонки з'являються хімічні опіки, а при потраплянні концентрованої сульфатної кислоти — навіть обвуглювання шкіри.
- При потраплянні на одяг з'являються дірки: одразу або після прання (в залежності від кількості кислоти). Тому з кислотами, особливо з концентрованими треба поводитися вкрай обережно.
- Працювати з ними бажано в гумових рукавичках.
- Якщо кислота випадково потрапила на шкіру, її треба негайно змити великою кількістю проточної води, а потім при необхідності змочити ушкоджену ділянку шкіри слабким розчином соди.
- При розбавленні концентрованих кислот обов’язково потрібно наливати тільки кислоту у склянку з водою, а не навпаки.
Оскільки хімія – наука експериментальна, то запрошую до проведення дослідів.
Хімічні властивості кислот, реакції заміщення та обміну:
Всі дані досліджень та результати записуємо у таблицю
|
№ пробірки |
Назва реагенту |
Рівняння реакції та ознаки |
Висновки |
|
1 |
Універсальний індикаторний папірець |
|
|
|
2 |
Індикатор метилоранж |
|
|
|
3 |
Індикатор фенолфталеїн |
|
|
|
4 |
Mg – магній порошкоподібний |
|
|
|
5 |
Zn – цинк гранульований |
|
|
|
6 |
Cu – мідний дріт |
|
|
|
7 |
Натрій гідроксид |
|
|
- Дослід №1 “Дія кислот на індикатори”.
Для початку пригадаємо, як визначити кислоту в розчині. (за допомогою індикаторів)
Учитель демонструє досліди: розчини хлоридної кислоти з універсальними індикаторними папірцем, метилоранжем, фенолфталеїном. Учні роблять висновок та вносять у таблицю
- Яким індикатором не можна визначити кислоту? (фенолфталеїн)
2. Лабораторний дослід №2 “Взаємодія кислот з металами”. У трьох пробірках знаходяться порошкоподібний магній, гранула цинку та шматочок міді. До кожної доливаємо розчин кислоти:
- У кожну пробірку з різними металами обережно доливаємо хлоридну кислоту об’ємом 1 мл. Результати спостережень записуємо у таблицю.
- Які реакції називають реакціями заміщення? Учні записують визначення з підручника на ст. ____.
- Лабораторний дослід № 3. « Взаємодія лугів з кислотами»
Розглянемо ще одну властивість кислот.
Прикладом ще однієї реакції обміну є взаємодія кислот з лугами.
Луги та кислоти – їдкі речовини, а в результаті їх взаємодії утворюється нейтральна сіль. Отже, луг та кислота взаємно нейтралізують один одного, через що реакцію між ними називають реакцією нейтралізації.
- Реакція нейтралізації – це реакція між кислотою та основою, у результаті якої утворюється сіль і вода.
У пробірку №7 налити розчин натрій гідроксиду, додати кілька крапель індикатору – розчину фенолфталеїну. До цього розчину долити по краплях розчин хлоридної кислоти. Спостерігати за змінами, які відбуваються у пробірці.
Результати та висновки записати в зошит
NaOH + HCl = NaCl + H2O
- Що таке реакція обміну? Учні записують визначення в зошит.
Реакція обміну – це реакція між двома складними речовинами, під час якої вони обмінюються своїми складовими частинами.
V. Закріплення нового матеріалу
Ми попрацювали дуже плідно, тому я пропоную вам реалізувати отримані знання.
- Метод «Коректор»
Послухайте твердження, і якщо ви не згідні із ним, встаньте
- Усі кислоти є розчинними у воді (Всі крім силікатної кислоти)
- Кислоти взаємодіють з усіма металами які розміщенні у ряді активності металів (Ні)
- Реакція нейтралізації – це реакція між кислотою та основою, у результаті якої утворюється сіль і вода (Так)
- При взаємодії кислот з металами утворюється вуглекислий газ (Ні. Водень)
- При роботі з кислотами не потрібно використовувати гумові рукавички (Ні)
- Індикатором фенолфталеїном не можна визначити кислоту (так)
- Вправа “Хмаринка”
Написати рівняння можливих реакцій з поміж даних речовин із нітратною кислотою

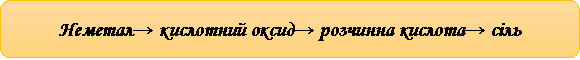
- Вправа «Ланцюжок перетворень»




Вr2 → НВr → МgВr2 → АgВr
VІ. Підбиття підсумків уроку
Метод «Ресторан»
Уявіть, що заняття ви провели в ресторані і тепер, я прошу вас виразити своє відношення до уроку, продовживши фрази:
- Я з'їв би цього ще……
- Більше всього мені сподобалось…
- Я майже перетравив….
- Я переїв….
- Будь ласка, добавте….
VІІ. Домашнє завдання
- Опрацювати § _____,
- Домашній експеримент : довести що у лимоні міститься кислота
- Здійснити перетворення
S → SO2 → H2SO3 → CaSO3


про публікацію авторської розробки
Додати розробку
