Завдання з розв'язками
Розв’язки
8 клас
1. Сполука на світлі або під час нагрівання розкладається на нітроген(ІV) оксид, кисень і воду в масовому співвідношенні 46 : 8 : 9.
1) Вивести формулу сполуки.
2) Написати рівняння реакції розкладу.
3) Обчислити масову частку сполуки в її розчині, якщо відомо, що молярні частки Гідрогену й Оксигену в цьому розчині однакові. Розв’язування
1. Складаємо мольне співвідношення речовин за
n = m /М. n(NО2) : n(О2) : n(Н2О) = m(NО2)/ M(NО2) : m(О2)/ M(О2):
: m(Н2О) / M(Н2О). M(NО2) 46 г/моль.
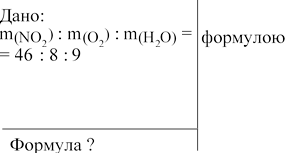 M(О2) = 32 г/моль. M(Н2О) = 18 г/моль.
M(О2) = 32 г/моль. M(Н2О) = 18 г/моль.
n(NО2) : n(О2) : n(Н2О) = 46/46 : 8/32 : 9 /18 = 1: 0,25: 0,5 =4 : 1: 2, отже,
NхНyОz = 4NО2 + О2 + 2Н2О
У продуктах реакції n(Н): n(N) : n(О) = 4: 4: 12 = 1: 1: 3. Отже, ця речовина
НNО3,
2) Рівняння хімічної реакції: 4НNО3 = 4NО2 + О2 + 2Н2О.
Відповідь: НNО3 – нітратна кислота.
3) У розчині знаходиться НNО3 і Н2О. Нехай:
х моль Н2О містить 2х моль Гідрогену та х моль Оксигену у моль НNО3 містить у моль Гідрогену та 3у моль Оксигену
За умовою молярні частки Гідрогену й Оксигену однакові, тобто
2х + у = х + 3у;
х = 2у, отже, на 1 моль НNО3 припадає 2 моль Н2О і m(розчину) = 63 г НNО3 + 2 · 18 г Н2О = 99 г
W(НNО3) = m(НNО3) / m(розчину) · 100% = 63 г / 99 г · 100% = 63,6%
2. Учень отримав завдання, в якому за назвами речовин слід було скласти їх хімічні формули. Виконуючи це завдання, він не залишав між формулами інтервали, в наслідок чого одержав запис:
H2OP2O5AlO2NaH2O3CO2Na3NCFeCl3N2K2SSiO2
1) Виділіть із цього запису формули індивідуальних речовин. (7 бала)
2) Укажіть, які із цих речовин є простими. (2 бала)
3) Як було сформульовано завдання, яке виконував учень? (6 балів)
Розв’язування
а) Формули індивідуальних речовин:
H2O; P2O5; Al; O2; Na; H2; O3; CO2; Na3N; C; FeCl3; N2; K2S; SiO2.
По 0,5 бала за кожну правильну формулу (0,5 · 14 = 7 бала)
б) Простими речовинами є: Al; O2; Na; H2; O3; C; N2. По 0,3 бала за кожну правильно визначену речовину (0,3 · 7 ~ 2 бала) в) Формулювання завдання:
«Складіть формули речовин, що мають такі назви: вода (чи гідроген оксид), фосфор(V) оксид, алюміній, кисень, натрій, водень, озон, вуглекислий газ (чи карбон(IV) оксид), натрій нітрид, вуглець (допускається – вугілля, алмаз, графіт тощо), ферум(III) хлорид, азот, калій сульфід, силіцій(IV) оксид (допускається – кремнезем)».
(6 балів)
3. У деяких європейських країнах у якості протиожеледного реагенту використовують частково зневоднений мінерал бішофіт (кристалогідрат солі металу IIА групи).
1) Визначте формулу безводної солі, в якій масова частка Хлору складає 74,74 %.
2) Визначте формулу кристалогідрату, якщо масова частка кристалізаційної води в ньому складає 27,48%.
3) Яку масу кристалогідрату і який об’єм води потрібно взяти для одержання 1 кг 8% (за масою) розчину?
4) На чому заснована дія бішофіту як протиожеледного реагенту?
Розв’язування
1. Оскольки метал знаходиться в IIА групі, то формула безводної солі – MeCl2. ω(Cl) = A(Cl)2/[A(Me) + A(Cl)2]
0,7474 = 71/(A(Me) + 71), звідки А(Ме) = 24. Метал – магній. 2. Встановлюємо формулу кристалогідрату. ω(H2O) = m(H2O)/m(кристалогідрату)
0,2748 = 18x/(24 + 71 +18x), звідки х = 2. Формула кристаллогидрата – MgCl2·2H2O.
3.m(MgCl2) = 1000 · 0,08 = 80 г n(MgCl2) = 80/95 = 0,84 моль n(MgCl2·2H2O) = 0,84 моль
m(MgCl2·2H2O) = 0,84 · 131 = 110,04 г 110 г
m(H2O) = 1000 – 110 = 890 г V(H2O) = 890 мл
4.Кристали частково зневодженого бішофіту поглинає вологу із навколишнього середовища. При переході із твердого стану в рідкий реагент виділяє теплоту, яка розтоплює сніг і кригу.
4. Двохосновна кислота і двохкислотна основа мають однакову молярну масу. При взаємодії цих речовин утворюється купорос. Відомо, що масова частка металічного елемента в основі удвічі більша за масову частку неметалічного елемента в кислоті, а масова частка Оксигену в кислоті у два рази більша за масову частку Оксигену в основі.
1) Визначте формули невідомих речовин.
2) Які речовини називають купоросами? Наведіть формулу купоросу, яка відповідає умові задачі.
3) Охарактеризуйте хімічні властивості кислоти і основи, зазначених у задачі (наведіть відповідні рівняння хімічних реакцій). Розв’язування
Оскільки двохкислотні основи містять у своєму складі двовалентний метал і дві гідроксильні групи, то загальна формула такої основи – Ме(ОН)2. Молекула двохосновної кислоти містить два атома Гідрогену, тому формула невідомої двохосновної кислоти (в загальному вигляді) – Н2ЕО4. Кислота містить 4 атоми Оксигену, оскільки, за умовою, масова частка Оксигену в кислоті в два рази більша за масову частку Оксигену в основі.
Нехай молярна маса елемента (Е) в кислоті дорівнює х г/моль, тоді молярна маса металу в основі дорівнюватиме 2х г/моль. М(Ме(ОН)2) = 2х+16·2+1·2 = 2х+34, М(Н2ЕО4) = 1·2+х+16·4 = х+66.
Прирівнюємо праві частини і знайдемо х: 2х+34 = х+66, откуда х = 32.
Хімічний елемент Сульфур має молярну масу атомів 32 г/моль, отже, двохосновна кислота – сульфатна Н2SО4. Молярна маса атомів метала в два рази більше – 64 г/моль, отже, основою є купрум(ІІ) гідроксид Cu(ОН)2.
5. Для опису електронної будови атома у сучасній науці широко використовуються такі параметри, як квантові числа. Квантові числа ‒ енергетичні параметри, які визначають стан електрона і тип атомної орбіталі, на якій він знаходиться.
Головне квaнтове число n визначає загальну енергію електрона і ступінь його віддалення від ядра (номер енергетичного рівня); воно приймає будь-які цілочислові значення, починаючи з 1 (n = 1, 2, 3, . . .)
Орбітальне (побічне чи азимутальне) квантове число l визначає форму атомної орбіталі. Воно може приймати цілочислові значення від 0 до n-1 (l = 0, 1, 2, 3,..., n-1). Кожному значенню l відповідає орбіталь особливої форми. Орбіталі з l = 0 називаються s-орбіталями, l =1 ‒ р-орбіталями (3 типа, що відрізняються магнітним квантовим числом m), l =2 ‒ d- орбіталями (5 типів), l = 3 ‒ f-орбіталями (7 типів).
Магнітне квантове число m визначає напрямок орбіталі в просторі. Його значення змінюються від +l до - l, включаючи 0. Наприклад, при l = 1 число m приймає 3 значення: +1, 0, -1, тому існують 3 типи р-АО: px, py, pz.
Спінове квантове число s може приймати лише два можливих значення +1/2 і -1/2. Вони відповідають двом можливим і протилежним один одному напрямками власного магнітного моменту електрона.
Уявіть собі, що паралельно з нашою існує деяка інший Всесвіт, населений аналогами людей – гоміноїдами. В цьому паралельному Всесвіті квантові числа мають наступні значення:
n = 1, 2, 3, ...
l = 0, 1, 2, ... (n-1)
m = -(l+1) ... (l+1) s = +1/2
Використовуючи символи хімічних елементів нашого Всесвіту:
1) побудуйте перші два періоди періодичної системи паралельного світу;
2) укажіть, що п’ють і чим вмиваються гоміноїди;
3) напишіть рівняння реакцій, яким відповідають в нашому світі горіння метану в кисні і поглинання продуктів літій гідроксидом.
Розв’язування
1)При значенні головного квантового числа 1 можливі такі набори квантових чисел:
(1,0,-1,1/2); (1,0,0,1/20; (1,0,1,1/2) (2 бали). При значенні головного квантового числа 2 –
(2,0,-1,1/2); (2,0,0,1/2); (2,0,1,1/2); (2,1,-2,1/2); (2,1,-1,1/2); (2,1,0,1/2); (2,1,1,1/2); (2,1,2,1/2) (2 бали).
Вид двох перших періодів періодичної системи:
|
H |
He |
Li |
|
|
|
|
|
|
Be |
B |
C |
N |
O |
F |
Ne |
Na |
(По 3 бали за кожний правильно складений період).
2) Аналогом води в такій системі буде гідроген флуорид HF. (1 бал) 3) Аналоги реакцій:
NH4 +2F2 = NF2 + 2H2F (2 бали)
NF2 + 2BeHF = Be2NF3 + H2F (2 бали).
9 клас
1. Сполука на світлі або під час нагрівання розкладається на нітроген(ІV) оксид, кисень і воду в масовому співвідношенні 46 : 8 : 9. 1) Вивести формулу сполуки. (2 бали)
2) Написати рівняння хімічної реакції. (2 бали)
3) Обчислити масову частку сполуки в її розчині, якщо відомо, що молярні частки Гідрогену й Оксигену в цьому розчині однакові. (4 бали)
4) Яка молярна концентрація такого розчину сполуки, якщо густина його дорівнює 1,385 г/мл? (3 бали)
5) Обчислити ступінь електролітичної дисоціації цієї сполуки, якщо відомо,
що розчин її містить стільки молекул, скільки й усіх йонів. (4 бали) Розв’язування
1. Складаємо мольне співвідношення речовин за
n = m /М. n(NО2) : n(О2) : n(Н2О) = m(NО2)/ M(NО2) : m(О2)/ M(О2):
: m(Н2О) / M(Н2О). M(NО2) 46 г/моль.
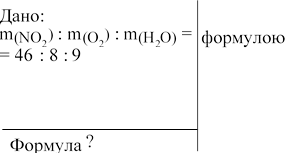 M(О2) = 32 г/моль. M(Н2О) = 18 г/моль.
M(О2) = 32 г/моль. M(Н2О) = 18 г/моль.
n(NО2) : n(О2) : n(Н2О) = 46/46 : 8/32 : 9 /18 = 1: 0,25: 0,5 =4 : 1: 2, отже,
NхНyОz = 4NО2 + О2 + 2Н2О
У продуктах реакції n(Н): n(N) : n(О) = 4: 4: 12 = 1: 1: 3. Отже, ця речовина
НNО3,
2) Рівняння хімічної реакції: 4НNО3 = 4NО2 + О2 + 2Н2О.
Відповідь: НNО3 – нітратна кислота.
3) У розчині знаходиться НNО3 і Н2О. Нехай:
х моль Н2О містить 2х моль Гідрогену та х моль Оксигену у моль НNО3 містить у моль Гідрогену та 3у моль Оксигену
За умовою молярні частки Гідрогену й Оксигену однакові, тобто
2х + у = х + 3у;
х = 2у, отже, на 1 моль НNО3 припадає 2 моль Н2О і m(розчину) = 63 г НNО3 + 2 · 18 г Н2О = 99 г
W(НNО3) = m(НNО3) / m(розчину) · 100% = 63 г / 99 г · 100% = 63,6%
4) Із розв’язаного завдання №3 випливає, що маса розчину кислоти становить 99 г, W(к-ти) = 63,6%, а за умовою ρ(НNО3) = 1,385 г/мл.
Об’єм розчину V = m/ρ = 99 г/1,385 г/мл = 71,5 мл або 0,0715 л, кількість речовини кислоти становить 1 моль.
С(НNО3) = n/V = 1 моль/0,0715 = 14 моль/л.
5) Нехай у розчині буде 100 молекул кислоти і 100 йонів, на які вона дисоціює:
НNО3 ↔ Н+ + N![]() .
.
Отже, на йони розпалися 50 молекул, тобто всього молекул в розчині буде 150.
α (НNО3) = 50/150·100% = 33,3%.
2. Щоб законсервувати овочі, зазвичай застосовують кухонну сіль і оцтову кислоту. Для консервування помідорів необхідно приготувати маринад, який містив би (по масі) 7% кухонної солі і 0,4% оцтової кислоти.
1) Розрахувати, яку масу солі і який об’єм оцтової есенції з масовою часткою кислоти 70% (густина 1,07 г/мл) необхідно додати до 3 л води для отримання маринаду. (5 балів)
2) Прийнявши, що ступінь дисоціації оцтової кислоти в отриманому маринаді дорівнює 0,56% і зробивши необхідні допущення, розрахувати в ньому концентрацію іонів Гідрогену (в моль/л). (5 балів) Розв’язування
1. Нехай для отримання маринаду до 3 л води необхідно додати х г NaCl і у мл оцтової есенції. Маса добавленої есенції дорівнює y∙1,07 г, і вона містить (y∙1,07∙0,70) г оцтової кислоти.
Маса виготовленого маринаду, зазначеного в умові складу буде дорівнювати
(3000 + х + у ∙ 1,07) г.
Складемо систему двох рівнянь для масових часток NaCl і CH3COOH:
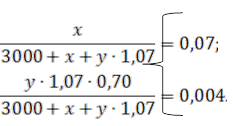
Розв’язуючи її, одержим: х = 227,2; у = 17,3. Таким чином, для виготовлення маринаду на 3 л води треба взяти 227,2 г солі і 17,3 мл оцтової есенції.
2. Для розрахунку молярної концентрації йонів Гідрогену необхідно знати об’єм розчину. Зробимо припущення, що густина одержаного розчину дорівнює 1 г/мл. Це не зовсім так, тому ми отримаємо лише приблизну оцінку концентрації йонів Гідрогену.
Добавили 17,3 мл, чи 17,3∙1,07 = 18,5 г оцтової есенції.
M(CH3COOH) = 60 г/моль.
В ній міститься 18,5∙0,70 = 12,95 г, чи = 0,216 моль оцтової кислоти.
CH3COOH ↔ CH3COOH¯ + H+
Оскільки, за умовою, ступінь дисоціації дорівнює 0,56%, чи 0,0056, то із добавленої кількості кислоти на йони продисоціює 0,0056×0,216 = 0,00121 моль. При цьому утвориться 0,00121 моль йонів Н+.
Маса розчину маринаду дорівнює (3000 + 18,5 + 227,2) = 3245,7 г, а приблизний об’єм складає 3245,7 мл = 3,25 л. Тоді молярна концентрація йонів H+ дорівнює 3,72 ∙ 10-4 моль/л.
3. На уроках хімії часто показують дослід «Вулканчик». Для його проведення речовину А насипають гіркою на металевий лист і підігрівають. Зовнішній ефект від цього досліду дуже нагадує виверження вулкана.
1) Встановити формулу вихідної речовини А, якщо відомо, що в результаті розкладання 0,4 моль цієї речовини утворюються: азот об'ємом 8,96 л (н.у.), 0,4 моль оксиду хрому, масова частка Оксигену в якому дорівнює 31,58%, і 28,8 г водяної пари. (5 балів)
2) Скласти рівняння цієї реакції. Навести для неї рівняння електронного балансу. Вказати, який елемент окиснюється, а який відновлюється; який елемент є окисником, а який відновником. (2 бали)
3) До якого типу окисно-відновних реакцій належить реакція розкладу речовини А? Написати рівняння ще однієї окисно-відновної реакції цього ж типу. (2 бали)
4) Які ще типи окисно-відновних реакцій ви знаєте? Навести по одному рівнянню реакцій в якості прикладів. (2 бали)
5) За довідниковими даними, при розкладанні 1 моль речовини А виділяється 503 кДж теплоти. Скільки енергії виділилося при розкладанні деякої порції речовини А, якщо маса твердого залишку виявилася на 10 г меншою за масу вихідної речовини? (4 бали)
Розв’язування
1) n(N2) = 8,96 л/22,4 л/моль = 0,4 моль; n(N) = 2·0,4 моль = 0,8 моль.
n(H2O) = 28,8 г/18 г/моль = 1,6 моль; n(Н) = 2·1,6 моль = 3,2 моль;
n(О) = 1,6 моль.
Встановимо формулу оксиду хрому. Виберемо для розрахунку 100 г цієї речовини. За умовою, в ній міститься: 100 г · 0,3158 = 31,58 г Оксигену і 100 г – 31,58 г = 68,42 г Хрому. Кількість речовин цих елементів:
n(Сr) = 68,42 г / 52 г/моль = 1,316 моль; n(О) = 31,58 г / 16 г/моль = 1,974 моль. Якщо представити формулу оксиду хрому у виді CrxOy, то x : y = n(Cr) : n(O) = 1,316 моль : 1,974 моль = 1 : 1,5 = 2 : 3.
Отже, формула оксиду хрома – Cr2O3. Це хром(ІІІ) оксид. (Можливий і інше виведення формули цієї речовини, наприклад, виходячи із загальної формули оксидів Cr2On).
В 0,4 моль Cr2O3 міститься: n(Cr) = 2 · 0,4 моль = 0,8 моль и n(О) = 3 · 0,4 моль = 1,2 моль.
Загальна кількість речовини Оксигену: n(O) = 1,6 моль + 1,2 моль = 2,8 моль.
Таким чином, 0,4 моль амоній дихромату містить:
0,8 моль атомів N; 3,2 моль атомів Н; 0,8 моль атомів Сr; 2,8 моль атомів О.
Отже, 1 моль амоній дихромату містить:
0,8 / 0,4 = 2 моль атомів N; 3,2 / 0,4 = 8 моль атомів Н; 0,8 / 0,4 = 2 моль атомів
Cr і 2,8 / 0,4 = 7 моль атомів O, тобто формула вихідної речовини – N2H8Cr2O7, чи
(NH4)2Cr2O7. (5 балів)
(Якщо учасник олімпіади початково знає формулу амоній дихромату і наводить її, а не встановлюють, то 5 балів виставляються тільки зп умови розрахункового підтвердження даних, зазначених у пункті 1) умови задачі.) 2) Рівняння реакції: (NH4)2Cr2O7 = N2↑ + Cr2O3 + 4H2O↑. Рівняння електронного балансу:
2N–3 – 6ē = N20 | 1 | (окислюється Нітроген); 2Сr+6 + 6ē = 2Cr+3| 1 | (відновлюється Хром). Окисником є атом Хрома у ступіню окиснення +6, відновником – атом Нітрогену у ступіню окиснення (–3). (2 бали)
3) Реакція розкладу амоній дихромату належить до внутрішньомолекулярним окисно-відновним реакціям. Приклад реакції цього ж типу: 2Cu(NO3)2 = 2CuO + 4NO2 + O2 (при нагріванні).
(2 бали)
4 Окисно-відновні реакції інших типів:
– міжмолекулярні: наприклад, S + O2 = SO2;
– диспропорціонування: наприклад, 2Н2О2 = 2Н2О + O2.
(2 бали)
5) При термічному розкладу амоній дихромату маса зразка зменшується за рахунок виділення азоту і пари води. У відповідності з рівнянням реакції, при розкладі 1 моль (NH4)2Cr2O7 виділяється 1 моль N2 і 4 моль H2O. Їх маса:
m(N2) = 1 моль · 28 г/моль = 28 г; m(Н2О) = 4 моль · 18 г/моль = 72 г.
Δm(зразка) = m(N2) + m(H2O); Δm(зразка) = 28 г + 72 г = 100 г.
Таким чином, при розкладі 1 моль амоній дихромату маса твердого залишку стає менше за масу вихідної речовини на 100 г.
Якщо маса твердого залишку, за умовою, стала на 10 г менше за масу вихідної речовини, отже, в реакцію розкладу вступило 0,1 моль амоній дихромату. Таким чином, при цьому виділилось 503 кДж/моль · 0,1 моль = 50,3 кДж теплоти.
(4 бали)
Всього за задачу – 15 балів.
4. Два гази X і Y здатні взаємно перетворюватися один в одного. Обидва вони зустрічаються в природі, обидва підтримують горіння тліючої скіпки. Газ Y на відміну від газу X викликає потемніння срібної пластинки. Газ X утворюється з газу
Y при пропущенні його через розчин калій йодиду:
KI + Y + H2O I2 + X + KOH
1) Назвати гази X і Y. (3 бали)
2) Скласти рівняння записаної вище реакції. (4 бали)
3) Яку роль відіграє газ Y у верхніх шарах земної атмосфери? (4 бали)
4) Записати рівняння реакції газу Y зі срібною пластинкою, якщо відомо, що продуктами її є газ Х і речовина Z, в якій масова частка Аргентуму складає 87,1%.(4 бали)
Розв’язування
1)Гази Х та У – це кисень О2 та озон О3. (4 бали)
2)Рівняння реакції: 2KI + O3 + H2O I2 + O2 + 2KOH (3 бали)
3)Озонований шар в стратосфері поглинає ультрафіолетове випромінювання Сонця і захищає від нього поверхню Землі та її мешканців. (4 бали)
4)Знайдемо формулу речовини Z. Ag:O = (87,1/108):(12,9/16) = 1:1.
Найпростіша формула – AgO.
Рівняння реакції: Ag + O3 = AgO + O2. (4 бали)
5. Електроліз 400 г розчину купрум(ІІ) сульфату з масовою часткою солі 8% вели протягом 160 хвилин до повного розкладу солі.
1) Написати рівняння процесів, що відбуваються на інертних електродах та загальне рівняння електролізу водного розчину солі. (3 бали)
2) Обчислити маси речовин, що виділились на електродах. (4 бали)
3) Знайти масову частку сульфатної кислоти в розчині. (4 бали)
4) Розрахувати силу струму, який пропустили через електролізер. (4 бали) Довідкові дані: стала Фарадея F=96500Кл/моль.
Розв’язування
1) Катод() Cu2+ + 2e Cu 2
Анод(+) 2H2O – 4e O2 + 4H+ 1
2CuSO4 + 2H2O 2Cu + O2 + 2H2SO4.
2) 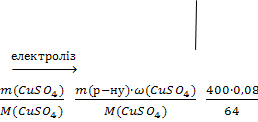 n(CuSO4) = = = =0,2 моль.
n(CuSO4) = = = =0,2 моль.
n(Cu) = 1/2n(O2) = n(CuSO4) m(Cu) = 0,2 моль64 г/моль = 12,8 г. m(O2) = 0,1 моль32 г/моль = 3,2 г. 3) m(H2SO4) = 0,2 моль98 г/моль = 19,6 г. m(р-ну) = 400 – (12,8+3,2) = 384 г. ( H2SO4) = 19,6/384 = 0,05 = 5%/ 4) За законом Фарадея: n=![]() ; I=
; I=![]() =4 А.
=4 А.
10 клас 1.Сполука на світлі або під час нагрівання розкладається на нітроген(ІV) оксид, кисень і воду в масовому співвідношенні 46 : 8 : 9.
1) Вивести формулу сполуки. (3 бали)
2) Написати рівняння хімічної реакції. (2 бали)
3) Обчислити масову частку сполуки в її розчині, якщо відомо, що молярні
частки Гідрогену й Оксигену в цьому розчині однакові. (3 бали)
4) Яка молярна концентрація такого розчину сполуки, якщо густина його
дорівнює 1,385 г/мл? (3 бали)
5) Обчислити ступінь електролітичної дисоціації цієї сполуки, якщо відомо,
що розчин її містить стільки молекул, скільки й усіх йонів. (3 бали)
6) Яку органічну речовину можна розпізнати за допомогою цієї сполуки? Скласти рівняння реакції. (1 бал)
Розв’язування
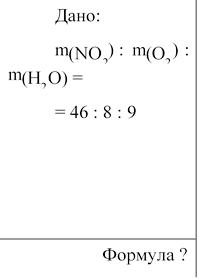 1. Складаємо мольне співвідношення речовин за формулою n = m /М.
1. Складаємо мольне співвідношення речовин за формулою n = m /М.
n(NО2) : n(О2) : n(Н2О) = m(NО2)/ M(NО2) : m(О2)/ M(О2):
: m(Н2О) / M(Н2О). M(NО2) 46 г/моль.
M(О2) = 32 г/моль.
M(Н2О) = 18 г/моль.
n(NО2) : n(О2) : n(Н2О) = 46/46 : 8/32 : 9 /18 = 1: 0,25: 0,5 =4 : 1: 2, отже, NхНyОz = 4NО2 + О2 + 2Н2О
У продуктах реакції n(Н): n(N) : n(О) = 4: 4: 12 = 1: 1: 3. Отже, ця речовина
НNО3,
2) Рівняння хімічної реакції: 4НNО3 = 4NО2 + О2 + 2Н2О.
Відповідь: НNО3 – нітратна кислота.
3) У розчині знаходиться НNО3 і Н2О. Нехай:
х моль Н2О містить 2х моль Гідрогену та х моль Оксигену у моль НNО3 містить у моль Гідрогену та 3у моль Оксигену
За умовою молярні частки Гідрогену й Оксигену однакові, тобто
2х+у =х +3у; х = 2у, отже, на 1 моль НNО3 припадає 2 моль Н2О і m(розчину) = 63 г НNО3 + 2 · 18 г Н2О = 99 г
W(НNО3) = m(НNО3) / m(розчину) · 100% = 63 г / 99 г · 100% = 63,6% 4) Із розв’язаного завдання №3 випливає, що маса розчину кислоти становить 99 г, W(к-ти) = 63,6%, а за умовою ρ(НNО3) = 1,385 г/мл.
Об’єм розчину V = m/ρ = 99 г/1,385 г/мл = 71,5 мл або 0,0715 л, кількість речовини кислоти становить 1 моль.
С(НNО3) = n/V = 1 моль/0,0715 = 14 моль/л.
5) Нехай у розчині буде 100 молекул кислоти і 100 йонів, на які вона дисоціює:
НNО3 ↔ Н+ + N![]() .
.
Отже, на йони розпалися 50 молекул, тобто всього молекул в розчині буде 150. α (НNО3) = 50/150·100% = 33,3%.
6) Можна розпізнати бензен, білок. При дії кислоти утворюється важка масляниста рідина жовтого кольору – нітробензен. С6Н6 + НNО3 → С6Н5NО2 + Н2О.
2. Петрик не встиг записати структурну формулу алкіну, що була на дошці, але в нього залишилась інформація про цю сполуку, яка йому допомогла. Відомо, що алкін має 5 атомів Карбону в основному ланцюзі, повністю приєднує 80 г брому з утворенням продукту реакції масою 104 г та не вступає в реакцію з аміачним розчином арґентум(І) оксиду.
1) Написати рівняння відповідної реакцій та знайти молекулярну формулу
алкіну; (4 бали)
2) Запропонувати структурну формулу отриманого алкіну та дати назву за номенклатурою IUPAC; (2 бали)
3) Написати структурні формули його ізомерів (за виключенням циклічних та міжкласових) та назвати їх за номенклатурою IUPAC; (22 бали)
4) Пояснити, чому цей алкін не взаємодіє з аміачним розчином арґентум(І) оксиду. (2 бали)
Розв’язування
За умовою задачі CnH2n-2+ 2Br2 → CnH2n-2Br4
ν(Br2) = 80/160 = 0,5 моль; згідно з рівнянням ν(CnH2n-2) = 0,5/2 = 0,25 моль. З бромом прореагувало 10480 = 24 г алкіну, отже його молярна маса дорівнює: М(CnH2n-2) = 24/0,25 = 96 г/моль, звідки виходить, що n = 7.
За умовою задачі цей алкін не взаємодіє з аміачним розчином арґентум оксиду, отже потрійний зв´язок знаходиться всередені молекули, оскільки в таку реакцію вступають тільки кінцеві атоми Гідрогену.
Існує тільки один алкін складу С7Н12 з 5 атомами Карбону в головному ланцюзі та потрійним зв´язком в положенні 2 – це 4,4-диметилпент-2-ін:
СH3
|
СH3–С–C≡CСH3
|
CH3
Ізомери: 4,4-диметилпент-1-ін; 3-гептін; 2-гептін; 3,4-диметилпент-1-ін;
3. Винахідливі та підприємливі японці помітили, що додавання в їжу сушених водоростей підсилює її смак та аромат. Причиною цього, як з’ясував учений К. Ікеда, є вміст у приправі глутамінової кислоти та її солей. Він запатентував свій винахід. Тепер увесь світ використовує глутамінову кислоту (Е 620) і натрій глутамат (Е 621) для покращення смаку й аромату харчових продуктів.
1)Записати формули глутамінової кислоти (2-амінопентадіова кислота) та натрій глутамінату або глутамату (моноформула) (3 бали)
2) Яке значення pH буде мати глутамінова кислота? Показати на прикладі
утворення біполярної молекули (внурішня сіль). (4 бали)
3) Що означають записи Е 620, Е 621 та де вони зустрічаються? (4 бал)
4) Обчислити маси вихідних речовин для добування натрій глутамату (Е 621) масою 330 г.(4 бали)
Розв’язування
1) НООС–СН2–СН2–СН(NН2)–СООН;
NаООС–СН2–СН2–СН(NН2)–СООН
2) pH < 7, оскільки це двохосновна кислота
••
НООС–СН2–СН2–СН(NН2)–СООН ↔ НООС–СН2–СН2–СН(NН3+)–СОО-
Цвіттер-йон
2) Це харчові добавки Е 620 і Е 621. Таке маркування можна побачити на упаковках продуктів харчування.
х г х г 338 г
4) НООС–СН2–СН2–СН(NН2)–СООН+NаОН→NаООС–СН2–СН2–СН(NН2)–СООН + Н2О
147 г 40 г 169 г
m(к-ти) = 294 г; m(NаОН) = 80 г
4. Білий фосфор Р4 – надзвичайно отруйний, особливо коли потрапляє в органи травлення або в легені у вигляді пари. Отруєння фосфором супроводжується болями в животі та блюванням масою, що пахне часником і світиться у темряві. Смертельна доза білого фосфору для людини становить лише 0,1 г.
У разі отруєння білим фосфором потерпілому дають пити блювотне – 20 г мідного купоросу, розчиненого у 2 л теплої води. Процеси, що перебігають в організмі хворого, зводяться до окисно-відновної реакції з утворенням міді та відносно нешкідливих кількостей ортофосфатної та сульфатної кислот.
1) Дописати рівняння знезараження білого фосфору та розставити
коефіцієнти методом електронного балансу: Р4+ СuSО4+Н2О → (5 балів)
2) Обчислити масову частку солі купрум(ІІ) сульфату в розчині мідного купоросу, який дають випити потерпілому. (5 балів)
3) Обчислити масу виготовленого розчину, яку потрібно отримати
потерпілому для повного окиснення 0,1 г фосфору? (5 балів) Розв’язування
0 +2 0 +5
1) ![]() + 10СuSО4 + 16Н2О = 10Сu↓ + 4Н3РО4 + 10Н2SО4
+ 10СuSО4 + 16Н2О = 10Сu↓ + 4Н3РО4 + 10Н2SО4
Сu+2 + 2 = Сu0 5 відновлення
![]()
![]() Р0 - 5 = Р+5 2 окиснення
Р0 - 5 = Р+5 2 окиснення
2) Маса розчину: m (р-ну) = m(СuSО4 · 5Н2О) + m(Н2О) = 20 г + 2000г = 2020 г m(Н2О) = ρ·V = 1 г/мл · 2000мл = 2000г
Маса солі СuSО4 в 20 г мідного купоросу: m(СuSО4) = 20 · 160/250 = 12,8 г Масова частка солі СuSО4 в розчині:
W(СuSО4) = m(СuSО4) / m (р-ну) ·100% = 12,8/2020 ·100% = 0,63%
0,1г х г
3) Р4 + 10 СuSО4 + 16 Н2О = 10 Сu +4Н3РО4 + 10 Н2 SО4
124г 10·160 г
m(СuSО4 ) = 0,1· 10·160 /124 = 1,29 (г) 0,63% = 1,29 / m (р-ну) · 100% m (р-ну) = 1,29 г · 100% / 0,63% = 205 г
Відповідь: маса виготовленого розчину для потерпілого, який отримав отруєння,
205 г.
5. Цинк і мідь одержали шляхом відновлення чадним газом із суміші оксидів масою 144,6 г, у якій кількості речовин цих оксидів відносяться як 1:2.
1) Знайти кількісний склад (моль) вихідної суміші. (4 бали)
2) Дати визначення тепловому ефекту реакції. Яким чином його можна розрахувати? (3 бали)
3) Обчислити тепловий ефект взаємодії молярних кількостей реагентів. (4 бали)
4) Визначити тепловий ефект відновлення металів із заданої суміші оксидів. (4 бали)
Довідкові дані. Стандартні ентальпії (теплоти) утворення ![]() речовин (кДж/моль): CuO (-165,3); ZnO (-350,6); CO (-110,5); CO2 (-393,3).
речовин (кДж/моль): CuO (-165,3); ZnO (-350,6); CO (-110,5); CO2 (-393,3).
Розв’язування 1) Вихідна суміш: ZnO – x моль, CuO – 2x моль.
m(ZnO) = Mn = 81x; m(CuO) = 280x
81x + 160x = 144,6 x = 0,6.
В суміші ZnO=0,6 моль; СuO = 1,2 моль. 2)ZnO + СО = Zn + CO2; CuO + CO – Cu + CO2.
За першим наслідком із закону Гесса:
rH=Hутв.(продуктів) Hутв.(реагентів).
3) rH1=(-393,3)(-110,5)(-350,6) = 67,8 (кДж/моль)
rH2=(-393,3)(-110,5)(-165,3) = -117,5 (кДж/моль)
4) rH1=67,8 кДж/моль0,6 моль = 40,7 кДж
rH2=(-117,5) кДж/моль1,2 моль = -141,0 кДж
Сумарний тепловий ефект
5) rH=rH1 + rH2=(-141,0)+40,7 = -100,3 кДж.
11 клас
1. Сполука на світлі або під час нагрівання розкладається на нітроген(ІV) оксид, кисень і воду в масовому співвідношенні 46 : 8 : 9.
1) Вивести формулу сполуки. (2 бали)
2) Написати рівняння хімічної реакції. (1 бал)
3) Обчислити масову частку сполуки в її розчині, якщо відомо, що молярні частки Гідрогену й Оксигену в цьому розчині однакові. (3 бали)
4) Яка молярна концентрація такого розчину сполуки, якщо густина його
дорівнює 1,385 г/мл? (2 бали)
5) Обчислити ступінь електролітичної дисоціації цієї сполуки, якщо відомо, що розчин її містить стільки молекул, скільки й усіх іонів. (3 бали)
6) Яку органічну речовину можна розпізнати за допомогою цієї сполуки? Скласти рівняння реакції. (1 бал)
7) Чи реагує дана сполука з простими речовинами. Якщо так, то яким чином (навести рівняння реакцій). (2 бали)
Розв’язування
1. Складаємо мольне співвідношення речовин за
n = m /М. n(NО2) : n(О2) : n(Н2О) = m(NО2)/ M(NО2) : m(О2)/ M(О2):
: m(Н2О) / M(Н2О). M(NО2) 46 г/моль.
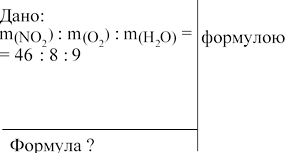 M(О2) = 32 г/моль. M(Н2О) = 18 г/моль.
M(О2) = 32 г/моль. M(Н2О) = 18 г/моль.
n(NО2) : n(О2) : n(Н2О) = 46/46 : 8/32 : 9 /18 = 1: 0,25: 0,5 =4 : 1: 2, отже,
NхНyОz = 4NО2 + О2 + 2Н2О
У продуктах реакції n(Н): n(N) : n(О) = 4: 4: 12 = 1: 1: 3. Отже, ця речовина
НNО3,
2) Рівняння хімічної реакції: 4НNО3 = 4NО2 + О2 + 2Н2О.
Відповідь: НNО3 – нітратна кислота.
3) У розчині знаходиться НNО3 і Н2О. Нехай:
х моль Н2О містить 2х моль Гідрогену та х моль Оксигену у моль НNО3 містить у моль Гідрогену та 3у моль Оксигену За умовою молярні частки Гідрогену й Оксигену однакові, тобто 2х + у = х + 3у;
х = 2у, отже, на 1 моль НNО3 припадає 2 моль Н2О і m(розчину) = 63 г НNО3 + 2 · 18 г Н2О = 99 г
W(НNО3) = m(НNО3) / m(розчину) · 100% = 63 г / 99 г · 100% = 63,6%
4) Із розв’язаного завдання №3 випливає, що маса розчину кислоти становить 99 г, W(к-ти) = 63,6%, а за умовою ρ(НNО3) = 1,385 г/мл.
Об’єм розчину V = m/ρ = 99 г/1,385 г/мл = 71,5 мл або 0,0715 л, кількість речовини кислоти становить 1 моль.
С(НNО3) = n/V = 1 моль/0,0715 = 14 моль/л.
5) Нехай у розчині буде 100 молекул кислоти і 100 йонів, на які вона дисоціює:
НNО3 ↔ Н+ + N![]() .
.
Отже, на йони розпалися 50 молекул, тобто всього молекул в розчині буде 150.
α (НNО3) = 50/150·100% = 33,3%.
6) Можна розпізнати бензен, білок. При дії кислоти утворюється важка масляниста рідина жовтого кольору – нітробензен. С6Н6 + НNО3 → С6Н5NО2 + Н2О.
7) При взаємодії нітратної кислоти з металами водень, як правило, не виділяється: він окиснюється, утворюючи воду. Кислота ж, залежно від концентрації і активності металу, може відновлюватися до сполук:
+5 +4 +3 +2 +1 0 -3 -3
HNO3 NO2 HNO2 NO NO N2 NH3 (NH4NO3).
Утворюється також сіль нітратної кислоти. Нижче наведено схему взаємодії нітратної кислоти різної концентрації з металами різної активності і вказано продукти її відновлення:
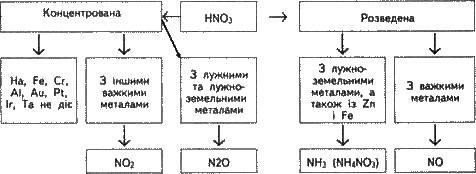
Розглянемо, наприклад, як буде реагувати концентрована і розведена нітратна кислота із сріблом.
Згідно зі схемою, концентрована нітратна кислота з важкими металами має відновлюватися до NO2; крім того, будуть утворюватися Н2О та сіль AgNO3. Запишемо схему реакції:
Ag + 2HNO3 (конц.) AgNO3 + NO2 + Н2О. Розведена нітратна кислота при взаємодії зі сріблом (важким металом) відновлюється до NO і утворюються вода і сіль АgNO3:
3Аg + 4HNO3(розв.) = 3АgNO3 + NO + 2Н2О;
Ще приклад: досить активний метал цинк залежно від концентрації нітратної кислоти може відновлювати її до оксиду нітрогену(l) N2O, вільного азоту N2 і навіть до аміаку NH3, який з надлишком нітратної кислоти дає нітрат амонію NH4NO3. В останньому випадку рівняння реакції слід записати так:
4Zn + 10HNO3 (дуже розв.) = 4Zn (NO3)2 + NH4NO3 + ЗН2О;
не взаємодіє з алюмінієм, хромом та залізом. Вона переводить їх у пасивний
стан.
Нітратна кислота не реагує з Pt, Rh, lr, Та, Au. Платина і золото розчиняються у ―царській водці" — суміші 3 об’ємів концентрованої хлоридної кислоти і 1 об’єму концентрованої нітратної кислоти.
Нітратна кислота взаємодіє з багатьма неметалами, окиснюючи їх до відповідних кислот. Наприклад:
S + 2НNO3 = H2SO4 + 2NO;
3Р + 5HNO3 + 2Н2О = 3Н3РО4 + 5NO; В + 3НNО3 = Н3ВО3 + 3NO2; С + 4HNO3 = СО2 + 2Н2О + 4NO2.
2. Практичне значення має клас органічних сполук під назвою складні ефіри (естери), які застосовуються у виробництві ліків, лакофарбових композицій, вибухових речовин тощо. Більшість естерів легко гідролізують в кислих або лужних умовах. Отже, після обробки водного розчину суміші двох естерів надлишком розчину лугу отримали наступні сполуки: гліцерол, натрій фенолят, натрій ацетат та натрій нітрат.
1) Записати структурні формули усіх сполук, що отримали після гідролізу. (4 бали)
2) Визначити та записати структурні формули естерів з яких утворилися продукти гідролізу. (4 бали)
3) Запропонувати відповідні рівняння реакцій гідролізу та умови їх перебігу. (4 бали)
4) Назвати один з можливих естерів, розчини якого використовують як вибухову речовину, а також у якості серцевих ліків та надати фармакопейну назву цього естеру. (2 бали)
Розв’язування
Структурні формули можливих естерів та схеми реакцій:
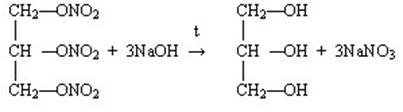
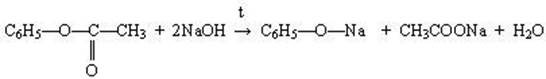
Сполука, що використовується як вибухова та як серцеві ліки – тринітрогліцерин. Це складний ефір (естер) гліцеролу та нітратної кислоти. Назва лікарського препарату «нітрогліцерин».
3. Нітробензенові кислоти широко використовуються в промисловості для синтезу цілої низки необхідних речовин, зокрема в синтезі азобарвників, лікарських сполук, пігментів, амінобензойних кислот. 3- та 4-нітробензенові кислоти та їх похідні мають бактеріостатичну та бактерицидну дії.
1) Запропонувати способи синтезу всіх ізомерних нітробензенових кислот із бензену та записати рівняння відповідних реакцій. (5 балів)
2) Пояснити, як різні замісники в ароматичних сполуках впливають на перебіг реакцій електрофільного заміщення в ароматичному ядрі. (4 бали)
3) Назвати ізомерні нітробензенові кислоти та порівняти їх кислотність з бензеновою кислотою. Пояснити, яка з них має найбільшу кислотність та чому? (4 балів)
Розв’язування
Нітробензенові кислоти в промисловості синтезують із толуену, який можна отримати за реакцією Фріделя-Крафтса:
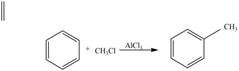
Оскільки метильна група відноситься до замісників І роду, то після нітрування толуену, в основному (м-ізомер складає всього 1,5%), утворюються два ізомери: онітротолуен та п-нітротолуен, які окиснюють перманганатом калію в кислому середовищі та отримують відповідні бензенові кислоти:
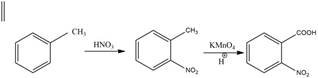
о-нітробензенова кислота
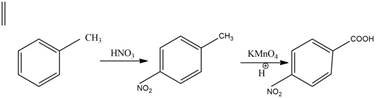 п-нітробензенова кислота Для отримання м-нітробензенової кислоти необхідно спочатку окиснити толуен до бензойної кислоти, яка є орієнтантом ІІ роду, після чого реакція нітрування відбувається з високим виходом продукту.
п-нітробензенова кислота Для отримання м-нітробензенової кислоти необхідно спочатку окиснити толуен до бензойної кислоти, яка є орієнтантом ІІ роду, після чого реакція нітрування відбувається з високим виходом продукту.
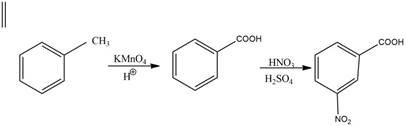
Орієнтанти І роду активують ароматичне ядро до реакцій електрофільного заміщення і не потребують використання каталізаторів. Орієнтують входження другого замісника в орто- та пара-положення.
Орієнтанти ІІ роду дезактивують ароматичне ядро до реакцій електрофільного заміщення, яке відбувається в мета-положення.
Нітробензенові кислоти більш сильні кислоти, чим бензенова кислота; на що впливає наявність електроноакцепторної групи -NO2. Серед нітробензенових кислот сильнішою є 2-нітробензенова кислота, на що впливає утворення внутрішньомолекулярних водневих зв´язків, між групами -СООН та -NO2.
4. Нагріванням суміші оксидів плюмбуму (+4) і хрому (+3) при 800°С отримано помаранчеву кристалічну речовину, що складається з 64,1% Плюмбуму, 16,1% Хрому, 19,8% Оксигену, і світло-жовтий порошок, в якому відношення масових частин Плюмбуму і Оксигену відповідно становить 12,95:1.
1) Визначити формули продуктів взаємодії оксидів. (4 бали)
2) Дати їм назви, написати рівняння реакції. (3 бали)
3) Розрахувати стехіометричне співвідношення мас реагентів. (4 бали)
4) Відомо, що отримана сіль здатна розчинятися в концентрованій сульфатній кислоті і концентрованому водному розчині натрій гідроксиду натрію. Написати рівняння відповідних хімічних реакцій. (3 бали)
Розв’язування
1) Визначимо формули солі PbxCryOz і оксиду PbvOw:
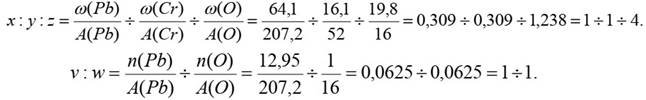
2) Формула солі – PbCrO4 назва – плюмбум(ІІ) хромат; Формула оксиду – PbO, назва – плюмбум(ІІ) оксид.
Представимо рівняння реакції одержання плюмбум хромату із запропонованих оксидів оксидів:
3PbO2 + Cr2O3 = 2PbCrO4 + PbO (1)
3) За рівнянням реакції обчислюємо стехіометричне співвідношення мас реагентів:
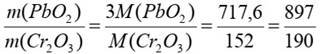
4)Запишемо рівняння реакцій взаємодії плюмбум хромату з концентрованою сульфатною кислотою і натрій гідроксидом:
PbCrO4 + H2SO4 = PbSO4 + CrO3 + H2O (2) чи
2PbCrO4 + 2H2SO4 = 2PbSO4 + H2Cr2O7 + H2O (2´) PbCrO4 + 4NaOH = Na2[Pb(OH)4] + Na2CrO4 (3)
5. Для реакції С(гр.) + Н2О(г) СО(г) + Н2(г) знайти:
1) 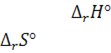 тепловий ефект реакції . Ендо- чи екзотермічною є ця реакція? (4 бали)
тепловий ефект реакції . Ендо- чи екзотермічною є ця реакція? (4 бали)
2) зміну ентропії . Вказати фізичний зміст ентропії. (4 бали)
3) Температуру, за якої реакція буде перебувати у стані хімічної рівноваги. (6 балів)
Довідкові дані. Ентальпія (теплота) утворення ![]() речовин (кДж/моль):
речовин (кДж/моль):
СО (-101,5); Н2О (-241,8).
Стандартні ентропії S речовин (Дж/мольК): CO (197,5); H2O (188,7); H2
(130,5); C (5,7).
Розв’язування
1) ![]() =-110,5(-241,8) = 131,3 кДж
=-110,5(-241,8) = 131,3 кДж
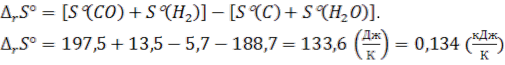 Реакція ендотермічна. Ентропія 2)
Реакція ендотермічна. Ентропія 2)
.
Ентропія є мірою молекулярної невпорядкованості системи, мірою знецінення енергії, тобто перетворення різних видів енергії в теплову.
3) ;
. Отже, ![]() =0, тобто
=0, тобто ![]() ;
;
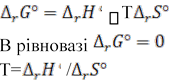 = 131,3/0,134 = 980 K.
= 131,3/0,134 = 980 K.


про публікацію авторської розробки
Додати розробку
