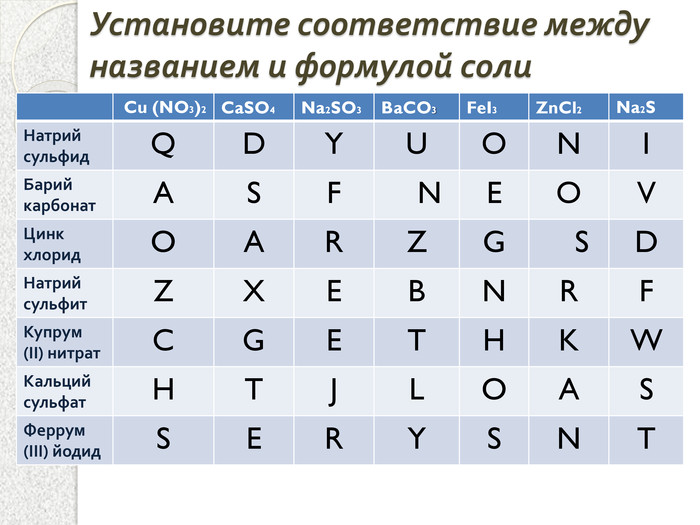
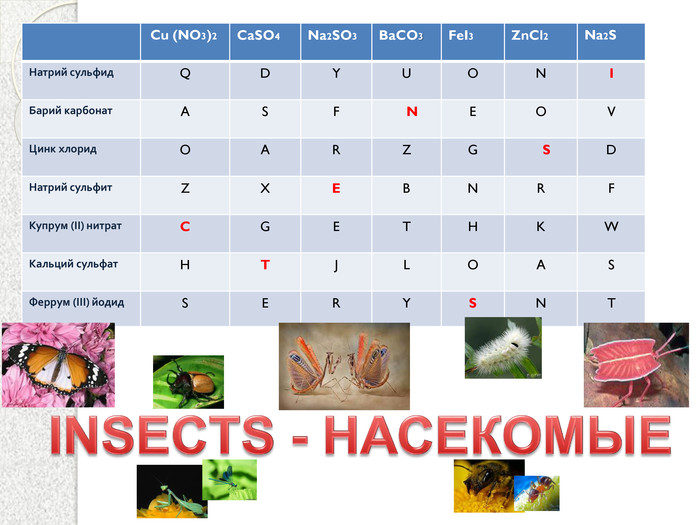
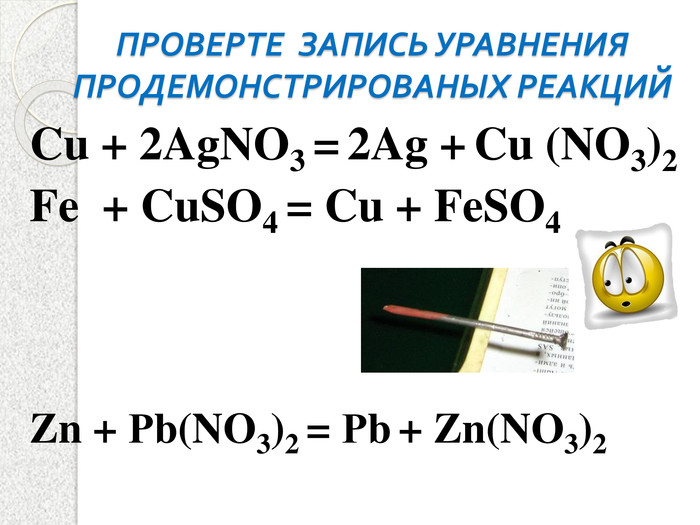
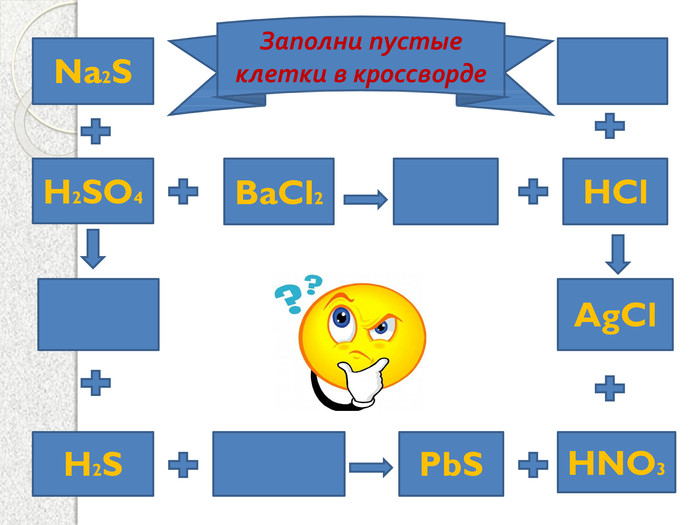
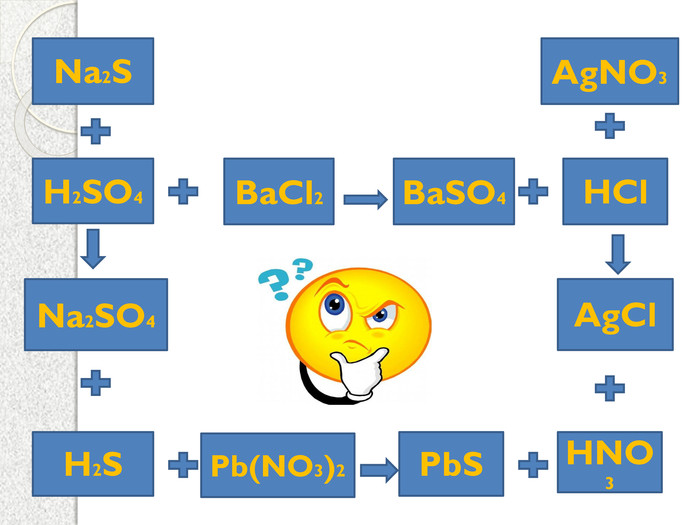
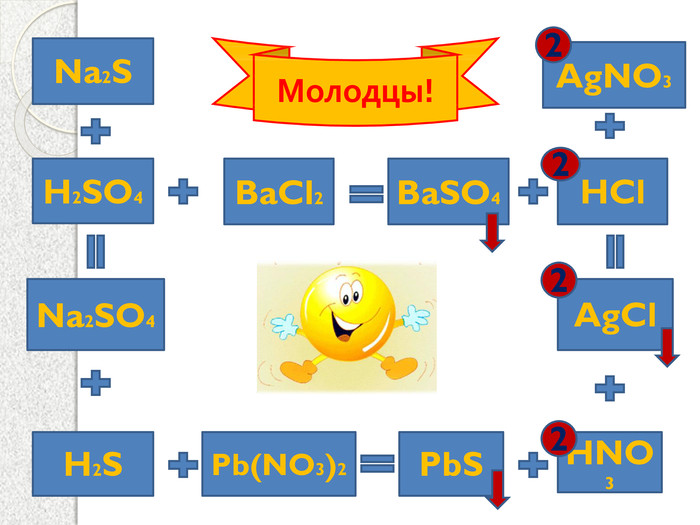
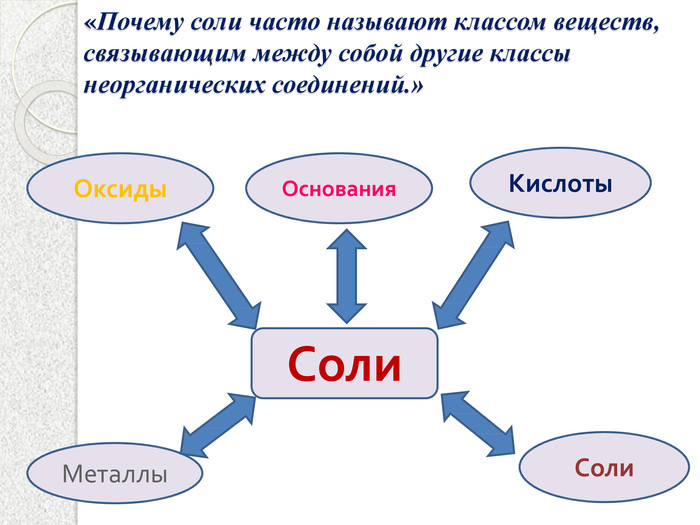
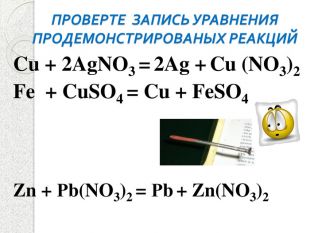
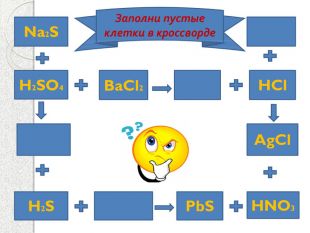
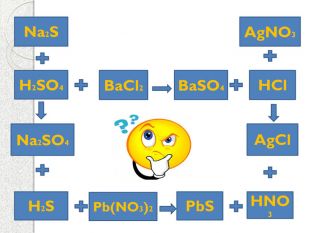
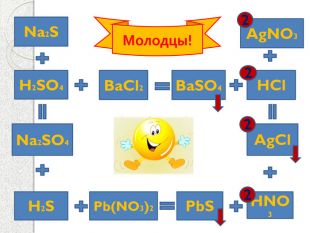
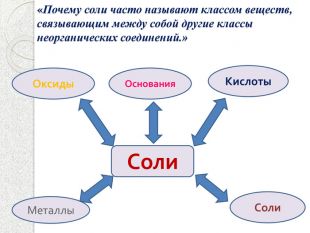
Презентация к уроку "Химические свойства солей"
Про матеріал
Урок проходить під девізом "Знание только тогда знание, когда оно приобретено усилиями своей мысли, а не памятью". Нетрадиційний урок з використанням власної віртуальної лабораторії, цікавими знахідками реалізації міжпредметних зв'язків. До уроку підібрана валеологічна пауза. В якості обладнання обладнання потрібна інтерактивна дошка.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Цікава презентація, оригінальна подача матеріалу!


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку