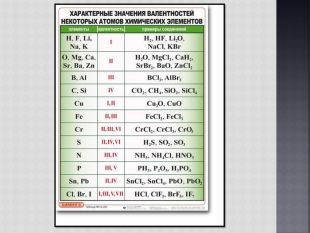
Презентация к уроку химии в 7 классе : "Составление формул бинарных соединений"
Про матеріал
Презентация к уроку химии в 7 классе : "Составление формул бинарных соединений"
Учащиеся изучают Закон постоянства состава веществ.
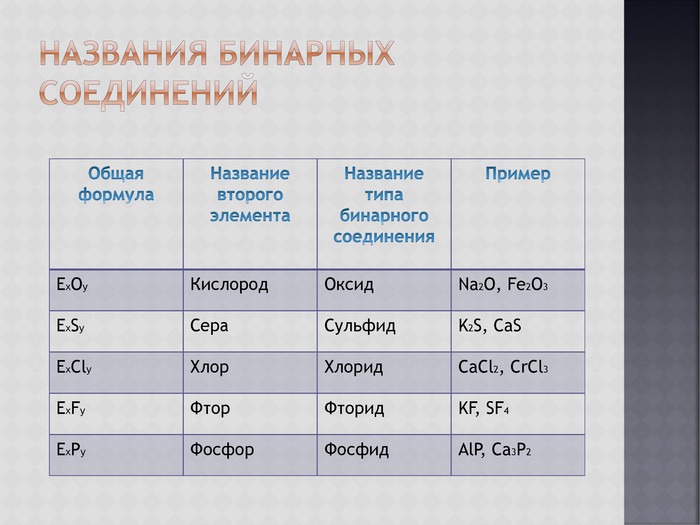
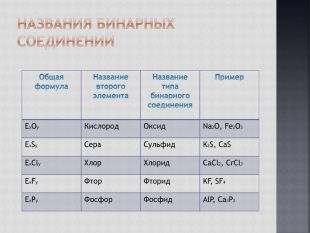
Знакомятся с понятием о бинарных соединениях; учатся составлять формулы бинарных соединений по наглядному образцу в презентации.
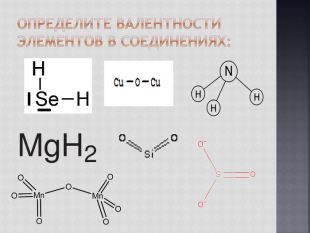
Осваивают алгоритм составления формул бинарных соединений по валентности элементов.
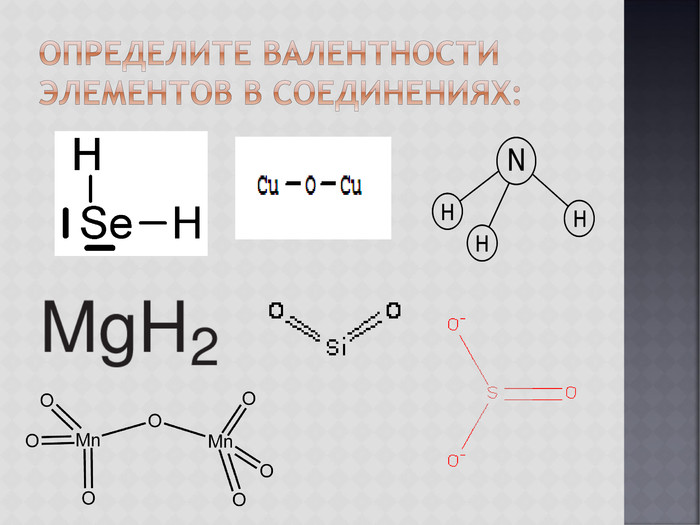
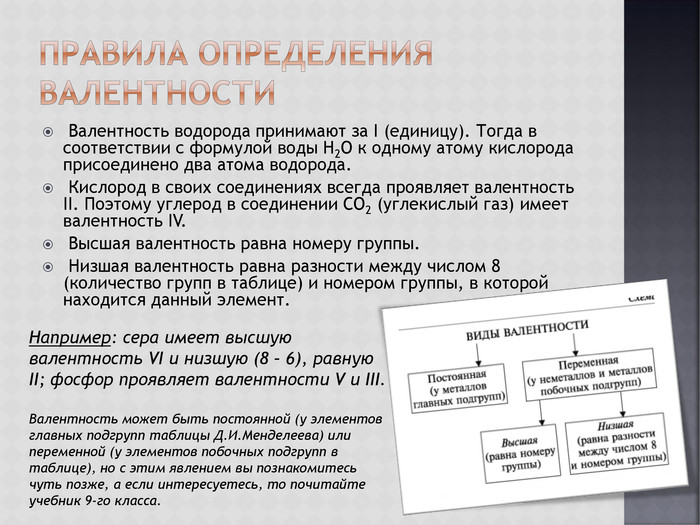
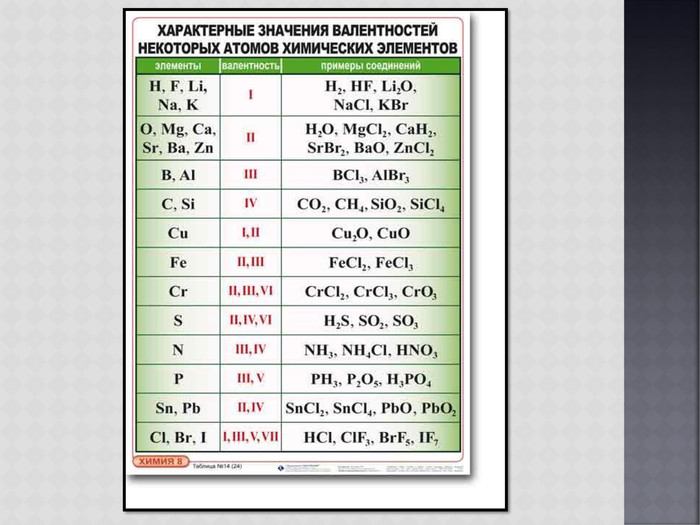
Учат правила определения валентности элементов.
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку