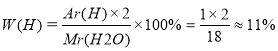Навчальний посібник "Система завдань з хімії"
У посібнику розроблені всі теми курсу хімії сьомого класу. Кожна тема містить опорний конспект з ключових питань теми, завдання для виконання на уроці та вдома, розміщені в порядку зростання їх складності, досліди з ужиткової хімії. Використання практично зорієнтованих завдань є одним із шляхів реалізації компетентнісного підходу в освіті й у той же час забезпечує підвищення ефективності навчального процесу. Посібник може бути використаним у процесі вивчення хімії учнями сьомих класів на уроках і при виконанні домашніх завдань.

система завдань з хімії для 7 класу
![]()
Тема 1. Хімія – природнича наука. Хімія в навколишньому світі
Тема 2. Короткі відомості з історії хімії
Тема 4. Речовини. Чисті речовини й суміші
Тема 6. Хімічні елементи, їхні назви та символи
Тема 7. Поняття про періодичну систему хімічних елементів Д.І.Менделєєва
Тема 8. Багатоманітність речовин. Прості й складні речовини. Метали й неметали
Тема 9. Хімічні формули речовин
Тема 10. Атомна одиниця маси. Відносна атомна маса хімічних елементів
Тема 11. Валентність хімічних елементів. Складання формул бінарних сполук за валентністю елементів
Тема 12. Визначення валентності за формулами бінарних сполук
Тема 13. Узагальнення та систематизація знань з теми «Початкові хімічні поняття»
Тема 14. Відносна молекулярна маса речовини, її обчислення за хімічною формулою
тема 15. Масова частка елемента в речовині
тема 16. Фізичні та хімічні явища
Тема 17. Фізичні й хімічні властивості речовини.
Тема 18. Практична робота 2. Дослідження фізичних і хімічних явищ
Тема 19. Закон збереження маси речовини
Тема 21. Узагальнення та систематизація знань з теми «Початкові хімічні поняття»
Тема 22. Оксиген. Кисень, склад його молекули, фізичні властивості, поширення в природі
Тема 23. Фізіологічна дія кисню. Добування кисню в лабораторії. Поняття про каталізатор
Тема 24. Хімічні властивості кисню
Тема 25. Практична робота 3. Добування кисню та вивчення його властивостей
Тема 26. Поняття про окиснення, горіння. Умови виникнення та припинення горіння
Тема 27. Колообіг Оксигену в природі. Застосування кисню
Тема 28. Ферум. Залізо. Фізичні властивості заліза. Поширення та застосування заліза
Тема 29. Хімічні властивості заліза. Руйнування (іржавіння) заліза в природних умовах
Тема 30. Узагальнення та систематизація знань з теми «Прості речовини»
Вступ
Хімія – наука, створена людьми і для людей. Хімія вдягає й будує, виплавляє метали й виготовляє скло, переробляє нафту й синтезує ліки. За кожною хімічною формулою, за кожним рівнянням реакції стоять речовини та перетворення, які можуть принести користь людині, а можуть завдати шкоди, внаслідок неправильного, необережного поводження з ними.
Виконуючи завдання, запропоновані в посібнику, проводячи досліди, ви зможете переконатися в тому, що хімічні явища супроводжують нас на кожному кроці, що знання хімії є корисним, важливим, а іноді – життєво необхідним.
Більшість завдань посібника складені на основі шкільної програми, проте деякі з них є більш складними та потребують для свого розв’язання додаткової інформації. Виконувати їх, чи ні – вирішувати вам. При виконанні завдань, їх умову переписувати не потрібно. Відповідь намагайтеся давати, по можливості повну, так, щоб із самої відповіді можна було зрозуміти, про що йшла мова в завданні.
Досліди, запропоновані в посібнику, проводяться вдома. Незважаючи на те, що більшість реактивів, які в них використовуються, – речовини, з якими ви повсякчас зустрічаєтеся в своєму житті, з метою дотримання правил техніки безпеки, усі досліди мають проводитися тільки в присутності дорослих.
Умови дослідів, як і завдань не переписуються. Для організації спостережень за ходом дослідів, кожен з них рекомендується описувати за наступною схемою:
- Назва досліду.
- Вихідні речовини (які речовини вступають в реакцію).
- Умови реакції (перемішування, нагрівання).
- Ознаки реакції (що спостерігали).
- Продукти реакції (що утворилося).
- Рівняння реакції (по можливості).
- Висновок.
Виконання запропонованих у посібнику завдань і дослідів дозволить вам не тільки засвоїти матеріал шкільного курсу, але й допоможе пов'язати хімічні знання з вашою повсякденною життєвою практикою.
Успіхів вам!
Тема 1. Хімія – природнича наука. Хімія в навколишньому світі
Завдання:
- вміти висловлювати судження про застосування хімічних знань.
Дорогі семикласники!
Ви починаєте вивчати хімію – науку про речовини та їх перетворення. На сьогодні відомо майже 20 млн. органічних і біля півмільйона неорганічних речовин. Деякі з них: кисень, вода, нафта, вугілля – дані нам природою. Але значно більше речовин, яких в природі взагалі не існувало, і які людина створила штучно: кераміка, скло, пластмаси, ліки, пальне, більшість металів тощо.
Знання з хімії стануть вам у пригоді як в повсякденному житті, так і в обраній вами професії, ким би ви не стали. І якщо ваша мета була благородною: нагодувати людей, вилікувати їх від хвороб, навчитися використовувати енергію вітру та Сонця, одержувати нові матеріали, досягнути її вам допоможе хімія.
Завдання 1.
Усі речовини поділяються на природні та на ті, які добуті штучно. Кожного дня ви користуєтеся предметами, виготовленими з них.
Запишіть у таблицю кілька предметів, якими ви користуєтеся найчастіше, вкажіть з якої речовини вони виготовлені: природної, чи створеної штучно.
|
№ |
Предмет |
Речовина, з якої він виготовлений |
Речовина природна, чи створена штучно |
|
1 |
|
|
|
Зробіть висновок: чи достатньо людині тих речовин, які дає природа?
Яка наука допомагає людині створювати нові речовини?
![]() Хімія – наука про речовини та їх перетворення.
Хімія – наука про речовини та їх перетворення.
Завдання хімії:
1. Вивчення вже існуючих речовин, їх властивостей, можливостей застосування.
2. Створення нових речовин з наперед заданими властивостями.
Завдання 2.
Складіть схему, яка відображала б зв’язок хімії з іншими природничими науками.
Завдання 3.
Вкажіть, які штучно створені речовини та матеріали, з нижченаведених застосовуються
а) в промисловості, б) в сільському господарстві, в) в транспорті.
Метали, скло, пластмаси, гума, мінеральні добрива, отрутохімікати, мастила, бензин, гас.
Завдання 4.
Запишіть, які штучно створені речовини та матеріали використовуються в побуті а) як ліки; б) як миючі засоби; в) як матеріали для виготовлення одягу і взуття; г) як матеріали для виготовлення меблів та побутової техніки; д) як матеріали для ремонту та упорядкування житла.
Завдання 5.
З якою метою людина використовує наступні хімічні реакції: горіння палива, випалювання глини, виплавка металів, бродіння цукристих речовин, реакція між питною содою і оцтовою кислотою?
Завдання 6.
Для представників яких професій особливо важливим є ґрунтовне знання хімії? Відповідь поясніть.
Домашня робота.
1. Давні люди не знали мила і бруд з тіла зчищали за допомогою глини; поки не було відкрите скло, у вікна вставляли пластинки слюди. Наведіть іще кілька прикладів того, як штучно створені речовини замінили природні.
2. Які штучно створені речовини та матеріали, є у вашому домі? Поясніть, як хімічні знання допомагають безпечно та ефективно використовувати ці речовини?
3. Закінчіть оповідання: «Хімія здавалася Петрикові складною і нецікавою наукою. «От, хоча б вона зникла», - нерідко думав Петрик. Добра фея вирішила виконати бажання хлопчика. Прокинувся він вранці, а хімія зникла…».
4*. Знайдіть у, засобах масової інформації повідомлення про роль хімії в житті людини. Як оцінюється ця роль: позитивно, чи негативно? У чому, на вашу думку, причина негативного ставлення до хімії, яке виникло в суспільній свідомості? А як ви оцінюєте значення хімії в житті людини?
Тема 2. Короткі відомості з історії хімії
Завдання:
- вміти висловлювати судження про історію розвитку хімічних знань.
|
Історичні періоди розвитку хімії |
Теоретичні уявлення |
Практичні здобутки |
|
Виникнення хімії (4-3 тис. до н. е.) |
Уявлення про атом – найдрібнішу частинку речовини. |
Виплавка заліза, міді, бронзи; виготовлення скла, кераміки, порце-ляни, паперу, пороху. |
|
Алхімічний період (ІV-ХVІ ст.) |
Мета алхімії – пошук філософського каменя, здатного перетворювати метали на золото, лікувати хвороби, повертати молодість. |
Відкриття та синтез сірчаної, соляної, азотної кислот, аміаку, лугів, фосфору, сполук металів; удосконалення техніки хімічного експерименту. |
|
Становлення хімії як науки (ХVІІ-ХVІІІ ст.) |
Уявлення про хімічний елемент (Р.Бойль), теорія флогістону (Г.Шталь), закон збереження маси речовини (М.В.Ломоно-сов), спростування теорії флогістону і створення кисневої теорії горіння (А.Лавуазьє) |
Впровадження кількісних методів дослідження, використання терезів, термометра, мікроскопа. Виробництво поташу (калійне добриво), міне-ральних фарб, переробка нафти, удосконалення металургійного процесу. |
|
Розвиток хімії як науки (ХІХ ст.) |
Атомно-молекулярне вчен-ня (М. В. Ломоносов, Джон Дальтон), відкриття періодичного закону (Д.І.Менделєєв), створення теорії будови органічних сполук (О.М.Бутлеров) |
Відкриття інертних газів, розвиток органічної хімії, відкриття радіоактивних елементів. |
|
Сучасна хімія (ХХ ст. – наш час) |
||
Завдання 1.
Коли виникла хімія? Які гіпотези щодо походження слова «хімія» вам відомі? Для відповіді скористайтеся схемою:


![]()
![]()
![]()
![]()
Завдання 2.
Які найважливіші здобутки основних періодів розвитку хімії?
Завдання 3.
У які періоди розвитку хімії людина навчилася отримувати залізо, скло, порох, сірчану кислоту, мінеральні фарби, пластмаси?
Завдання 4.
Який з періодів розвитку хімії на вашу думку є найважливішим? Чому?
Завдання 5.
У чому ви вбачаєте переваги та недоліки алхімічного періоду розвитку хімії?
Завдання 6.
З іменами яких вчених пов’язана історія розвитку хімії? Який вклад у розвиток хімічної науки вони здійснили?
Домашня робота.
1. Доповніть таблицю найважливішими відкриттями сучасного періоду розвитку хімії (ХХ століття – наш час).
2. Підготуйте повідомлення про один з етапів розвитку хімії або про одного з видатних вчених-хіміків.
3. (попереднє). На наступному уроці ви будете виконувати практичну роботу «Правила поведінки учнів у хімічному кабінеті». Для підготовки до цієї роботи кілька разів уважно перечитайте правила поведінки та правила техніки безпеки при роботі в кабінеті хімії. Випишіть ті правила поведінки та правила техніки безпеки, які, на вашу думку, є найбільш важливими. Вивчіть їх.
4*. Складіть пам’ятку для учня при роботі в кабінеті хімії, зобразивши правила поведінки та правила техніки безпеки за допомогою умовних знаків або малюнків.
Завдання:
- вміти називати обладнання кабінету хімії, лабораторний посуд;
- дотримуватися правил техніки безпеки під час роботи в хімічному кабінеті
Обладнання: лабораторний штатив, спиртівка, сірники, пробірка, побіркотримач, штатив для пробірок, чашечка для випарювання, склянка з водою.
Хід роботи:
Завдання 1.
Перевір свої знання правил техніки безпеки. Виконай тести:
1. Чи зобов’язаний ти працювати в кабінеті хімії в халаті під час практичної роботи?
а) зобов’язаний; б) не зобов’язаний; в) за вказівкою вчителя.
2. Що перш за все треба зробити якщо ти отримав термічний опік?
а) полити місце опіку водою з-під крана;
б) повідомити вчителя або лаборанта;
в) закрити місце опіку долонею.
3. Що перш за все треба зробити якщо упала і розбилася пробірка з рідиною?
а) повідомити вчителя або лаборанта;
б) зібрати уламки скла, а потім витерти рідину;
в) витерти рідину, а потім зібрати уламки скла.
4. Що перш за все треба зробити якщо під час занять виникла пожежа?
а) швидко вибігти з класу;
б) почати тушити пожежу;
в) діяти за вказівкою вчителя.
5. Що перш за все треба зробити якщо їдка рідина потрапила на халат?
а) зняти халат;
б) повідомити вчителя або лаборанта;
в) змити рідину чистою водою.
6. Що перш за все треба зробити якщо їдка рідина потрапила на шкіру рук?
а) стряхнути краплі;
б) промити шкіру великою кількістю води;
в) обробити нейтралізуючим розчином.
7. Що перш за все треба зробити якщо їдка рідина потрапила в око?
а) промити око чистою водою;
б) звернутися до лікаря;
в) промити око борною кислотою.
8. Що ти повинен зробити, якщо одержиш травму під час уроку?
а) негайно звернутися до вчителя;
б) звернутися до вчителя в кінці уроку;
в) самому собі надати допомогу.
Завдання 2. Які правила техніки безпеки при роботі в кабінеті хімії можуть бути зображені за допомогою наступних знаків:
![]()
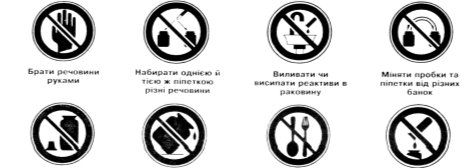
Завдання 3. Ознайомтеся з будовою та прийомами поводження з пробіркотримачем
а) замалюйте пробіркотримач. Яке призначення цього приладу?
б) закріпіть пробірку в пробіркотримачі, а потім вийміть її. Поясніть, чому пробірка має прокручуватися? У якій частині слід закріплювати пробірку? Як вийняти пробірку з тримача?
Завдання 4. Ознайомтеся з правилами поводження з спиртівкою.
а) замалюйте спиртівку, позначте її частини: сухий спирт, підставка, ковпачок;
б) чому іноді сухий спирт може потріскувати? Як цьому запобігти?
Як запалити та погасити сухий спирт?
в) складіть інструкцію з техніки безпеки при поводженні з спиртівкою.
Завдання 5. Ознайомтеся з будовою полум’я спиртівки.
а) розгляньте полум’я спиртівки, визначте, з яких частин воно складається;
б) внесіть сірник у темну частину полум’я, почекайте поки він загориться. Другий сірник внесіть у верхню частину полум’я. Який сірник загорівся швидше? Чому? В якій частині полум’я слід вести нагрівання?
в) як слід нагрівати пробірку? Чому не можна заглядати в пробірку під час нагрівання? Як запобігти викиду рідини з пробірки? Чому отвір пробірки не можна направляти ні на себе, ні на товаришів?
г) налийте в пробірку води на 1/3, затисніть її в пробіркотримачі та закип’ятіть її вміст на спиртівці. Охолодіть пробірку та поставте її в штатив для пробірок.
Завдання 6. Зробіть висновок про те, чому ви навчилися на практичній роботі.
Домашня робота.
1. Замалюйте та підпишіть хімічний посуд та обладнання.
2. Які з правил поведінки та правил техніки безпеки при роботі в кабінеті хімії варто виконувати і в повсякденному житті?
3. До чого може привести невиконання правил поведінки та правил техніки безпеки при роботі в кабінеті хімії. Відповідь ілюструйте конкретними прикладами.
4. Дослід. Вивчення горіння парафінової свічки. (Дослід проводиться тільки в присутності дорослих).
Піднесіть сірник до ґнота свічки й швидко відведіть руку з ним назад. Чи загорілася свічка? Піднесіть запалений сірник до ґнота й потримайте його довше. Що сталося з парафіном, перш ніж загорілася свічка? Насправді, горить не ґніт, а пари парафіну. Розплавлений парафін піднімається по ґноту вгору, випаровуються, а вже потім загораються. Уважно розгляньте полум’я. У темній частині навколо ґнота температура найнижча, тут парафін не горить, а тільки випаровується. Якщо в цю зону вставити скляну трубку, то пари парафіну, які по ній йтимуть, можна буде підпалити на іншому кінці цієї трубки. Жовта частина полум’я має температуру біля 1000ºС. Тут парафін згорає з утворенням вуглекислого газу, водяної пари та частинок сажі. Зовнішня блакитна частина полум’я має найвищу температуру. Тут відбувається повне згорання парафіну. Внесіть у полум’я свічку скіпку та потримайте її кілька секунд. Там, де скіпка обвуглиться – температура полум’я найнижча. Замалюйте в зошиті будову полум’я та обвуглену скіпку.
Тема 4. Речовини. Чисті речовини й суміші
Завдання:
- вміти розрізняти фізичні тіла, речовини, матеріали, чисті речовини й суміші
- повторити способи розділення сумішей.
![]() Речовина – це те, з чого складається фізичне тіло. Наприклад:
Речовина – це те, з чого складається фізичне тіло. Наприклад:
|
Фізичне тіло |
Речовина |
|
- зошит |
- папір |
|
- ручка |
- пластмаса |
|
- сніжинка |
- вода |
Матеріал – речовина, яка використовується для виготовлення предметів (фізичних тіл).
Фізичні властивості речовин:
1. Агрегатний стан (тверда речовина, рідина, газ).
2. Колір.
3. Запах.
4. Смак. НЕ КУШТУВАТИ !!!
5. Розчинність у воді.
6. Густина.
7. Теплопровідність, електропровідність.
8. Температура плавлення, температура кипіння.
• Речовини складаються з атомів. Сполучаючись між собою атоми утворюють молекули.
Чисті речовини – це речовини, які містять молекули лише
однієї речовини.
Такі речовини в природі не зустрічаються.
Суміші – це речовини, які містять молекули різних речовин.
Наприклад: повітря, молоко, сплави металів.
![]()
![]() Суміші
Суміші
неоднорідні однорідні
(вода й пісок, кров, цитоплазма) (повітря, сплави, морська вода)
Основні способи розділення сумішей
1. Відстоювання. 2. Фільтрування. 3. Випарювання.
Завдання 1.
1. Випишіть окремо назви речовин і тіл: а) з такого переліку: склянка, кисень, ключ, крижина, ртуть, вода, залізо; б) з переліку будівельних матеріалів: черепиця, вапно, труба, гіпс.
Завдання 2.
Наведіть приклади предметів, створених людиною, та матеріалів, з яких вони виготовлені. Поясніть, чи кожна речовина може використовуватися як матеріал?
Завдання 3.
Які з наведених властивостей характеризують тіла, а які – речовини:
а) блиск
б) маса
в) об’єм
г) розчинність у воді
д) форма
е) колір
є) агрегатний стан
Завдання 4. Опишіть фізичні властивості речовин, заповніть таблицю:
|
Фізичні властивості речовини |
Алюміній |
Кисень |
Бензин |
Цукор |
|
1. Агрегатний стан. |
|
|
|
|
|
2. Колір, блиск |
|
|
|
|
|
3. Запах. |
|
|
|
|
|
4. Смак. |
|
|
|
|
|
5.Розчинність у воді. |
|
|
|
|
|
6. Густина відносно води (тобто більша, чи менша за 1г/см3) |
|
|
|
|
|
7. Теплопровідність |
|
|
|
|
|
8. Електропровідність |
|
|
|
|
Завдання 5.
З якими фізичними властивостями пов’язане найбільш відоме застосування: а) скла; б) міді; в) заліза? Наявність яких властивостей можна вважати недоліком при даному практичному застосуванню їх?
Завдання 6.
Якими способами (відстоювання, фільтрування, випарювання, дія магнітом) можна розділити суміш:
а) води та бензину;
б) цукру та піску;
в) кухонної солі, залізних ошурок, деревного вугілля.
Домашня робота.
1. Випишіть окремо назви тіл і речовин:
а) Пробірка, крейда, залізо, цвях, торф, алюмінієва ложка, вода, кисень.
б) Пластмаса, керамічний глечик, бавовна, нафта, скло, вікно, м’яч, книга.
в) Труба, колба, мідний дріт, цвях, сода, мармур, парафін, олія, колесо.
2. Чим схожі і чим відрізняються за властивостями:
а) глина і пластилін;
б) кухонна сіль «Екстра» і лимонна кислота;
в) алюміній і мідь;
3. Якими способами (відстоювання, фільтрування, випарювання, дія магнітом) можна розділити суміш:
а) крейди та солі;
б) мідних і залізних ошурок;
в) цукру, сірки, крейди.
4*. Через високий вміст солей морська вода непридатна до пиття. Опишіть спосіб, за допомогою якого можна отримати чашку питної води з відра морської води.
Завдання:
- вміти розрізняти атоми, молекули, йони.
![]() Атом – електронейтральна частинка, складова частина будь-якої речовини.
Атом – електронейтральна частинка, складова частина будь-якої речовини.
Атом складається з ядра, навколо якого рухаються електрони. В ядрі атома містяться протони і нейтрони.
|
Складові частинки атома |
Їх умовне позначення |
Заряд |
Маса (атомні одиниці маси) |
|
Протон |
р |
+1 |
1 |
|
Нейтрон |
n |
0 |
1 |
|
Електрон |
ē |
-1 |
0 |
Сполучаючись між собою, атоми можуть утворювати молекули.
На сьогодні доведено існування 112 різновидів атомів, які відрізняються кількістю частинок, які їх складають, масою, розмірами.
З атомів складається величезна кількість різних молекул. Так, лише атоми Гідрогену і Оксигену, сполучаючись різним чином, утворюють молекули водню, кисню, озону, води, гідроген пероксиду (див. схему):
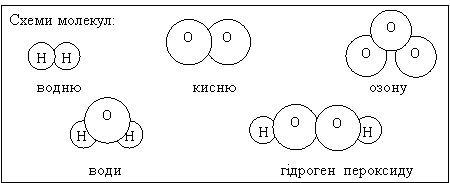
Втрачаючи, або приєднуючи електрони, атом перетворюється на заряджену частинку – йон.
Хімічний елемент – це певний вид атомів.
Завдання 1.
Вставте пропущені слова (атом, молекула, йон).
Речовини складаються з ___. Сполучаючись між собою ___ утворюють ____. У результаті втрати або прийняття електрона, ___ перетворюється на ___.
Завдання 2.
Що таке атом? Замалюйте схему будови атома, підпишіть назви частинок, які входять до складу атома.
Завдання 3.
Які з перерахованих ознак стосуються атома:
а) у природі трапляється обмежена кількість видів; б) агрегатний стан; в) хімічно неподільна частка; г) температура плавлення?
Завдання 4.
Що утвориться, якщо атом втратить або приєднає електрон?
а) молекула; б) інший атом; в) йон; г) хімічний елемент.
Завдання 5.
Чому не мають змісту вирази: атом водню, атом води, атом цукру?
Завдання 6.
Порівняйте схеми будови молекули води за Дальтоном (мал. 1) та із сучасної точки зору (мал. 2). Як змінилися в наш час уявлення про будову молекули води?

Домашня робота.
1. Користуючись підручником, випишіть визначення понять: атом, молекула, йон, хімічний елемент.
2. Вставте пропущені слова (атом, молекула):
а) До складу ___ води входять два ___ Гідрогену і один ___ Оксигену;
б) ___ кисню складається з двох ___ Оксигену, а ___ озону складається з трьох ___ Оксигену.
3. Розмістіть поняття “молекула”, “речовина”, “атом”, “тіло”, таким чином, щоб кожен попередній термін був “цеглинкою” для будівництва наступного.
4*. Античні вчені використовували поняття атом, коли пояснювали а) випаровування води, б) відчуття запаху, в) розчинення солі в воді тощо. Що вони доводили цим у будові речовини, та яку неточність допускали? Поясніть ці явища з сучасної точки зору.
Тема 6. Хімічні елементи, їхні назви та символи
Завдання:
- вміти називати хімічні елементи (не менше 20-ти) за сучасною науковою українською номенклатурою, записувати їхні символи;
Завдання 1.
Пригадайте символи хімічних елементів, вивчені вами в курсі природознавства, і встановіть відповідність між символом хімічного елемента та його назвою:
1) Н; 2) О; 3) С; 4) N; 5) Sі; 6) Fе; 7) Аl; 8) Сu
а) Оксиген; б) Карбон; в) Силіцій; г) Алюміній;
д) Купрум; е) Нітроген; ж) Ферум; є) Гідроген.
Завдання 2.
Користуючись періодичною системою хімічних елементів проставте в таблиці символи хімічних елементів.
|
№ |
символ |
вимова |
нова назва |
традиційна назва |
|
1 |
|
аш |
Гідроген |
водень |
|
8 |
|
о |
Оксиген |
кисень |
|
6 |
|
це |
Карбон |
вуглець |
|
7 |
|
ен |
Нітроген |
азот |
|
15 |
|
пе |
Фосфор |
фосфор |
|
16 |
|
ес |
Сульфур |
сірка |
|
9 |
|
фтор |
Флуор |
фтор |
|
17 |
|
хлор |
Хлор |
хлор |
|
35 |
|
бром |
Бром |
бром |
|
53 |
|
йод |
Йод |
йод |
|
11 |
|
натрій |
Натрій |
натрій |
|
19 |
|
калій |
Калій |
калій |
|
47 |
|
аргентум |
Аргентум |
срібло |
|
12 |
|
магній |
Магній |
магній |
|
20 |
|
кальцій |
Кальцій |
кальцій |
|
56 |
|
барій |
Барій |
барій |
|
30 |
|
цинк |
Цинк |
цинк |
|
29 |
|
купрум |
Купрум |
мідь |
|
26 |
|
ферум |
Ферум |
залізо |
|
13 |
|
алюміній |
Алюміній |
алюміній |
|
14 |
|
силіцій |
Силіцій |
кремній |
|
25 |
|
манган |
Манган |
марганець |
Завдання 3.
Користуючись періодичною системою запишіть символи хімічних елементів:
Хлору, Магнію, Алюмінію, Калію, Натрію, Меркурію, Флуору, Феруму, Оксигену, Цинку, Гідрогену, Кальцію, Хлору, Силіцію, Сульфуру, Купруму.
Завдання 4.
![]() Кросворд. Заповни по вертикалі пусті клітини назвами таких елементів: Сl, Н, Р, О, В, Вr, F.
Кросворд. Заповни по вертикалі пусті клітини назвами таких елементів: Сl, Н, Р, О, В, Вr, F.
О О О О О О О
Домашня робота.
1. Встановіть відповідність між назвами і символами хімічних елементів :
1) Кальцій а) І
2) Іод б) К
3) Калій в) Сl
4) Карбон г) S
5)Сульфур д) Са
6) Хлор е) С
2. Який елемент є найпоширенішим: а) у земній корі; б) у гідросфері; в) в атмосфері; г) у космосі? Запишіть символи цих елементів.
3. Виготовте картки на яких запиши символи вивчених хімічних елементів, а на звороті – їхні назви. Користуючись картками, вивчіть символи та назви елементів.
4*.Складіть шаради про назви хімічних елементів за наведеним зразком:
Шарада. Якщо відкинути першу букву в моїй назві – я перетворюся в напій, якщо змінити першу букву – в інший хімічний елемент, якщо змінити третю букву – в церков. Хто я? (Вr – Сr – храм).
Тема 7. Поняття про періодичну систему хімічних елементів Д.І.Менделєєва
Завдання:
- вміти використовувати періодичну систему як довідкову.
![]() У 1869 році видатний російський хімік Д. І. Менделєєв створив періодичний закон, який дозволив систематизувати всі хімічні елементи і розмістити їх у певному порядку.
У 1869 році видатний російський хімік Д. І. Менделєєв створив періодичний закон, який дозволив систематизувати всі хімічні елементи і розмістити їх у певному порядку.
Графічним виразом періодичного закону є періодична система хімічних елементів. Кожен хімічний елемент має у цій системі певний порядковий номер.
Порядковий номер – найважливіша характеристика хімічного елемента. Порядковий номер вказує на кількість протонів у ядрі атома елемента, а отже, і на заряд ядра атома.
У періодичній системі 8 груп.
Група – вертикальний стовпчик елементів, у якому розміщені подібні за властивостями хімічні елементи.
На сьогодні у періодичній системі 7 періодів.
Період – горизонтальний рядок елементів, у якому хімічні елементи розміщені за зростанням їх порядкових номерів.
Завдання 1.
Яке з наведених визначень відповідає групі, а яке – періоду:
а) вертикальний стовпчик хімічних елементів;
б) горизонтальний рядок хімічних елементів.
Завдання 2.
Запишіть порядкові номери та символи елементів Кальцію, Карбону, Феруму, Флуору, Гелію, Гідрогену, Брому, Бору, Калію.
Завдання 3.
Знайдіть у періодичній системі елементи з зарядом ядер атомів +6, +15, +26, +47, +79, +2, +7, +8, +17, +18 і запишіть їх символи.
Завдання 4.
Який елемент розміщений: а) у першому періоді, першій групі; б) у третьому періоді, четвертій групі; в) у другому періоді, шостій групі.
Завдання 5.
Охарактеризуйте місце в періодичній системі (порядковий номер, період, група) Оксигену, Карбону, Флуору, Хлору, Феруму.
Завдання 6.
Ці три радіоактивних метали (лише один з них зустрічається в природі, два інших синтезовані штучно) розміщені в періодичній системі один за одним, як і планети Сонячної системи, на честь яких вони названі. Про які метали йде мова? Вкажіть їх положення в періодичній системі.
Домашня робота.
1. Запишіть порядкові номери та символи елементів Гідрогену, Алюмінію, Брому, Калію, Сульфуру, Нітрогену, Фосфору, Силіцію.
2. Знайдіть у періодичній системі елементи з зарядом ядер атомів +9, +11, +12, +13, +19, +29, +20, +47, +5, +16 і запишіть їх символи.
3. Охарактеризуйте місце в періодичній системі (порядковий номер, період, група) Натрію, Магнію, Кальцію, Алюмінію, Йоду.
4*. Про які елементи йде мова? Зазначте їх назви, символи, порядкові номери, період та групу в якій вони знаходяться.
а) Арістотель назвав цю речовину “живим сріблом”, латинська назва цього елемента означає “срібна вода”.
б) Цей хімічний елемент спочатку був відкритий на Сонці, а вже потім на Землі, що й засвідчує його назва.
в) За кілька тисячоліть до нашої ери людина навчилася добувати цей метал з його руд. Такими рудами був багатий острів Кіпр. Латинська назва цього елемента походить від назви даного острова.
г) З незапам’ятних часів краса цього металу приваблювала людей. Колір його порівнювали з кольором вранішньої зорі, що знайшло відображення в латинській назві металу.
д) Які елементи названі на честь держав – сусідів України?
е)Алхіміки називали цей елемент “жовч бога Вулкана”, за жовтий колір простої речовини ним утвореної. Що це за елемент і що це за речовина?
є) Який елемент названо за його неприємний запах? Цей елемент утворює просту речовину – рідину.
ж) Одна з країн Південної Америки отримала назву на честь цього елементу. Іспанські конкістадори побачили на місцевих жителях велику кількість прикрас з цього металу. І хоча пізніше з’ясувалося, що жодного власного родовища цього металу в країні немає і він привозиться з сусідньої Болівії, назву країни змінювати не стали. Що це за країна і що це за метал?
з)Трагічно закінчувалися спроби вчених отримати просту речовину, утворену цим елементом: вибухали лабораторії, гинули вчені. Коли нарешті у 1886 році Анрі Муасон отримав цю речовину, за дану роботу він був удостоєний Нобелівської премії. А елемент назвали “руйнівником”
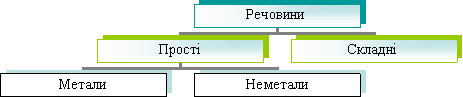
Тема 8. Багатоманітність речовин. Прості й складні речовини. Метали й неметали
Завдання:
- вміти наводити приклади металічних і неметалічних елементів; простих і складних речовин;
- розрізняти прості та складні речовини;
- висловлювати судження про багатоманітність речовин.
![]()
Завдання 1. Заповніть пропуски в таблиці.
|
Назва елемента |
Символ елемента |
Назва простої речовини |
|
Купрум |
|
|
|
|
Н |
|
|
|
|
Кисень, озон |
|
|
|
Залізо |
|
|
|
Графіт, алмаз |
Завдання 2.
Розподіліть наступні речовини на прості та складні:
Цинк (Zn), цукор (С12Н22О11) , вуглекислий газ (СО2), кисень (О2), азот (N2), алюміній (Аl), водень (Н2) , вода (Н2О) , сірка (S8), залізо (Fe), питна сода (NаНСО3), алмаз (С), крейда (СаСО3), фулурен (С60), гелій (Не).
Завдання 3.
У яких випадках йде мова про хімічний елемент, а в яких – про просту речовину?
1) а) глина містить багато АЛЮМІНІЮ
б) АЛЮМІНІЙ добре проводить електричний струм
в) відносна атомна маса АЛЮМІНІЮ – 27
г) частка АЛЮМІНІЮ в земній корі – 8%
д) АЛЮМІНІЙ – легкий метал
2) а) білий ФОСФОР отруйний
б) ФОСФОР входить до складу кісток та мозку
в) ФОСФОР входить до складу фосфорних добрив
г) червоний ФОСФОР використовується при виробництві сірників
д) порядковий номер ФОСФОРУ в періодичній системі 15
Завдання 4.
Розгляньте видані зразки простих речовин – металів і неметалів, занесіть їхні назви і властивості до таблиці:
|
Фізичні властивості речовин |
Метали |
Неметали |
||
|
|
|
|
|
|
|
1. Агрегатний стан. |
|
|
|
|
|
2. Колір, блиск |
|
|
|
|
|
3. Запах. |
|
|
|
|
|
4. Смак. |
|
|
|
|
|
5.Розчинність у воді. |
|
|
|
|
|
6. Теплопровідність |
|
|
|
|
|
7. Електропровідність |
|
|
|
|
Завдання 5.
Зробіть висновок про характерні фізичні властивості металів, виписавши їх з наступного переліку властивостей речовин: газоподібні речовини; як правило тверді речовини; рідини; без кольору; мають металічний блиск; сріблясті або жовтуваті; діелектрики; пластичні; теплопровідні, електро-провідні; міцні; неміцні; добре розчиняються у воді;
Завдання 6.
Випишіть назви речовин, про які йде мова в завданні. Які хімічні елементи входять до їх складу? Які це речовини – прості чи складні?
а) молекула водню складається з двох атомів Гідрогену, молекула кисню складається з двох атомів Оксигену. Сполучаючись між собою водень і кисень утворюють воду;
б) при згоранні природний газ метан, молекула якого складається з атома Карбону й чотирьох атомів Гідрогену, сполучається з киснем. При цьому утворюється вуглекислий газ і вода;
в) мінерал малахіт блакитно-зеленого кольору при нагріванні перетворюється на чорний порошок купрум оксиду (СuО), газ, який входить до складу газованих напоїв і воду.
Домашня робота.
1. Визначте, які з перерахованих речовин є простими, а які – складними: чадний газ (СО), йод (І2), метан (СН4), фосфор (Р4), спирт (С2Н5ОН), водень (Н2), борна кислота (Н3ВО3), озон (О3), кисень (О2), гідроген пероксид (Н2О2).
2. У яких випадках йде мова про хімічний елемент, а в яких – про просту речовину? Доповніть речення, вставивши назву елемента або простої речовини у відповідних відмінках:
1) Вставте слова «Сульфур» або «сірка» в залежності від того, йде мова про хімічний елемент чи про просту речовину:
а) молекула сірчаної кислоти містить один атом ___;
б) ___ входить до складу білків;
в) із залізного колчедану добувають ___;
г) ___ в порошкоподібному стані не змочується водою і плаває на поверхні води, тоді як шматок ___ тоне у воді;
д) при виготовленні гуми каучук нагрівають з ___.
2) Вставте слова «Ферум» або «залізо» в залежності від того, йде мова про хімічний елемент чи про просту речовину:
а) ___ притягується магнітом;
б) ___ входить до складу крові;
в) у яблуках міститься багато ___;
г) на металургійних заводах отримують ___;
д) температура плавлення ___ 1539ºС.
3. Які фізичні властивості характерні для металів? Наведіть приклади простих речовин металів і неметалів.
4. Випишіть назви речовин, про які йде мова в завданні. Які хімічні елементи входять до їх складу? Які це речовини – прості чи складні?
а) під час нагрівання у вакуумі алмаз (проста речовина, утворена елементом Карбоном) перетворюється на графіт;
б) під час нагрівання до високої температури цукру утворюється вуглець і вода;
в) під час нагрівання тверда речовина червоного кольору перетворюється на сріблясті краплі іншої речовини, яка використовується в термометрах і газ, в якому спалахує тліюча скіпка;
Тема 9. Хімічні формули речовин
Завдання:
- навчитися записувати хімічні формули простих і складних речовин, користуючись хімічними символами, індексами, коефіцієнтами;
- навчитися пояснювати зміст хімічних формул;
- навчитися описувати й аналізувати якісний і кількісний склад речовин за хімічними формулами;
![]() Хімічна формула – запис складу речовини за допомогою хімічних символів та індексів.
Хімічна формула – запис складу речовини за допомогою хімічних символів та індексів.
Індекс – число, яке позначає кількість атомів даного елемента у молекулі речовини. Індекс записується справа внизу від символу елемента.
Коефіцієнт – число, яке позначає кількість молекул, або окремих атомів. Коефіцієнт записується перед формулою або хімічним символом.
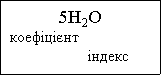 Запис 5Н2О означає 5 молекул води,
Запис 5Н2О означає 5 молекул води,
![]()
![]() кожна з яких складається з 2 атомів
кожна з яких складається з 2 атомів
Гідрогену та одного атома Оксисену
(індекс 1 – не пишеться).
Завдання 1.
Підкресліть у наведених формулах індекси – однією рискою, коефіцієнти – двома рисками. Що означає індекс? Коефіцієнт?
2О, СН4, 2СО, Р4, 4Р, 8S8, Н2, 5Н, 7О, О3, Н2О2, 2Н2О, С12Н22О11.
Завдання 2.
Встановіть відповідність:
1) F2 а) дві молекули води;
2) 2Н2О б) молекула водню;
3) 3N в) три атоми Нітрогену;
4) 5Сl2 г) молекула фтору
5) Н2 д) п’ять молекул хлору
Завдання 3.
Позначте за допомогою хімічних символів, індексів та коефіцієнтів:
а) один атом Гідрогену; б) два атоми Гідрогену; в) молекулу водню, що складається з двох атомів Гідрогену; г) дві молекули водню.
Завдання 4.
Напишіть формулу речовини, яка складається:
а) з двох атомів Гідрогену й одного атома Оксигену (вода);
б) з одного атома Кальцію, одного атома Карбону, трьох атомів Оксигену (крейда, вапняк);
в) з дванадцяти атомів Карбону, двадцяти двох атомів Гідрогену, одинадцяти атомів Оксисену (сахароза).
Завдання 5.
Дайте характеристику речовини за слідуючим планом:
1. Назва речовини.
2. Проста чи складна.
3. Якісний склад.
4. Кількісний склад.
а) Н2О б) СО2 в) СаСО3 г) О2
Завдання 6.
Формула сульфатної кислоти – Н2SО4, а формула фосфатної кислоти Н3РО4. Порівняйте якісний і кількісний склад цих кислот. Що в них спільного та чим вони відрізняються?
Домашня робота.
1. Що показує хімічна формула, індекс, коефіцієнт? Наведіть приклади.
2. Запишіть за допомогою хімічних символів, індексів, коефіцієнтів:
а) один атом Оксигену;
б) два атоми Оксигену;
в) молекулу кисню, що складається з двох атомів Оксигену;
г) молекулу озону, що складається з трьох атомів Оксигену;
г) три молекули кисню.
3. Запишіть формулу речовини, яка складається:
а) з одного атома Натрію і одного атома Хлору (кухонна сіль);
б) з одного атома Карбону чотирьох атомів Гідрогену (метан);
в) з одного атома Натрію, одного атома Гідрогену, одного атома Карбону, трьох атомів Оксигену (питна сода);
4. Порівняйте якісний і кількісний склад води Н2О і гідроген пероксиду (перекису водню) Н2О2. Що в них спільного та чим вони відрізняються?
Тема 10. Атомна одиниця маси. Відносна атомна маса хімічних елементів
Завдання:
- вміти визначати відносну атомну масу хімічних елементів за періодичною системою
![]() Маса атома дуже мале число.
Маса атома дуже мале число.
Наприклад. m(Н) = 0,00000000000000000000000163 г.
Як правило використовують відносні атомні маси.
Відносна атомна маса елемента – це відношення маси його атома до 1/12 маси атома Карбону.
• Аr – відносна атомна маса .
Аr(С) = 12; Аr (Н) = 1; Аr(О) = 16 і т. д.
• Аr – відносна атомна маса – завжди ціле число.
Виключення: Аr(Сl) = 35,5
• Аr кожного елемента можна знайти в періодичній системі.
![]() Н 1 ----------- порядковий номер
Н 1 ----------- порядковий номер
1,0079 ------------- Аr
Завдання1. Користуючись періодичною системою хімічних елементів проставте в таблиці символи та відносні атомні маси хімічних елементів.
|
№ |
символ |
вимова |
нова назва |
традиційна назва |
Аr |
|
1 |
|
аш |
Гідроген |
водень |
|
|
8 |
|
о |
Оксиген |
кисень |
|
|
6 |
|
це |
Карбон |
вуглець |
|
|
7 |
|
ен |
Нітроген |
азот |
|
|
15 |
|
пе |
Фосфор |
фосфор |
|
|
16 |
|
ес |
Сульфур |
сірка |
|
|
9 |
|
фтор |
Флуор |
фтор |
|
|
17 |
|
хлор |
Хлор |
хлор |
|
|
35 |
|
бром |
Бром |
бром |
|
|
53 |
|
йод |
Йод |
йод |
|
|
11 |
|
натрій |
Натрій |
натрій |
|
|
19 |
|
калій |
Калій |
калій |
|
|
47 |
|
аргентум |
Аргентум |
срібло |
|
|
12 |
|
магній |
Магній |
магній |
|
|
20 |
|
кальцій |
Кальцій |
кальцій |
|
|
56 |
|
барій |
Барій |
барій |
|
|
30 |
|
цинк |
Цинк |
цинк |
|
|
29 |
|
купрум |
Купрум |
мідь |
|
|
26 |
|
ферум |
Ферум |
залізо |
|
|
13 |
|
алюміній |
Алюміній |
алюміній |
|
|
14 |
|
силіцій |
Силіцій |
кремній |
|
|
25 |
|
манган |
Манган |
марганець |
|
Завдання 2.
Користуючись таблицею атомних мас, обчисліть у скільки разів:
а) атом Купруму важчий за атом Оксигену
б) атом Оксигену легший за атом Сульфуру
в) атом Магнію важчий за атом Карбону
г) атом Гідрогену легший за атом Феруму
Завдання 3.
Знайдіть якомога більше пар елементів, відношення атомних мас яких становить: а) 1:2; б) 1:3; в)1:4.
Завдання 4.
У земній корі міститься однакове число атомів Феруму і Кальцію. Чи однакові маси цих елементів у земній корі? Якщо ні, то маса якого з них більша й у скільки разів?
Домашня робота.
1.Розставте елементи у порядку збільшення значення їх відносних атомних мас: Бром, Йод, Магній, Неон, Цинк, Аргентум, Вольфрам.
2.Відносні атомні маси яких елементів становлять: 1; 12; 23; 35,5; 56; 16; 14; 107? Запишіть символи та назви цих елементів.
3.Який атом важчий: Карбону чи Титану ? У скільки разів?
4.Що легше: а) два атоми Хрому чи три атоми Сульфуру; б) п’ять атомів Нітрогену чи чотири атоми Оксигену?
Тема 11. Валентність хімічних елементів. Складання формул бінарних сполук за валентністю елементів
Завдання:
- розкрити суть поняття валентність;
- навчитися складати формули бінарних сполук за валентністю
![]() Валентність – властивість атомів утворювати певну кількість хімічних зв’язків.
Валентність – властивість атомів утворювати певну кількість хімічних зв’язків.
Валентність показує яку кількість ковалентних хімічних зв’язків може утворити даний елемент.
Валентність позначають римською цифрою, яку надписують над символом елемента.
Елементи
![]()
![]()
з постійною валентністю зі змінною валентністю
Наприклад: Н – І С – ІІ , IV
О – ІІ S – II , IV , VI
Аl – ІІІ Fe – II , III
Валентність часто дорівнює номеру групи, або (8 мінус номер групи). Валентність елемента не перевищує 8.
Завдання 1.
Користуючись підручником, запишіть у робочий зошит визначення поняття валентність.
Завдання 2.
Визначте валентність елементів за структурними формулами речовин (рискою позначається хімічний зв’язок), зазначте валентність римською цифрою над символом елемента.
а) НСl Н – Сl д) СО С = О
б) Н2О Н – О – Н е) СО2 О = С = О
в) О2 О = О є) Н2 Н – Н
![]() Н
Н
![]()
![]() г) NН3 Н – N – Н ж) СН4 Н – С – Н
г) NН3 Н – N – Н ж) СН4 Н – С – Н
Н Н
Завдання 3.
Елементи: Н, О, С, N, Р, S, F, Cl, Вr, I, Na, К, Мg, Сa, Вa, Zn, Сu, Fe, Аl, Si розподіліть на дві групи: елементи з постійною валентність та елементи зі змінною валентністю, зазначте можливі значення валентності кожного елемента.
Складання формул бінарних сполук за валентністю.
Бінарні сполуки – це сполуки утворені атомами двох хімічних елементів. Наприклад: Н2О, NаСl, НF.
Щоб скласти формулу бінарної сполук за валентністю необхідно:
|
№ |
Послідовність дій |
Приклад |
|
1. |
Запишіть символи двох хімічних елементів поряд |
РО МgN SО NаСl |
|
2. |
Позначте валентність обох елементів |
V ІІ ІІ ІІ VІ ІІ І І РО МgN S О NаСl |
|
3. |
Запишіть числа – значення валентностей навхрест, як індекси сусідніх елементів ! Якщо індекси можна скоротити, це обов’язково потрібно зробити (див. SО3) ! Індекс 1 не пишеться(див. NаСl) |
V ІІ ІІ ІІІ VІ ІІ І І Р2О5 Мg3N2 SО3 NаСl |
Завдання 4.
Складіть формули за валентністю (зазначено валентність елементів зі змінною валентністю):
IV V II II IV II
а) S О , К Сl , Р О , Sі О , Nа S , Мg S , С О , Сu О , Аl S, Н О;
VI IV II IV II III
б) Sі Н , S О , N О , Fе Сl , С О , С О , Вa О , Fе Сl , Nа О , Nа Н;
II III II II II II
в) Аg Сl , К О , Zn S , N О , Fе Сl , Аl Сl , Сu S , Fе S , Нg О , К І
Завдання 5.
Знайдіть і виправте помилки, допущені при складанні формул сполук за валентністю:
МgО2, Аl2О3, К1Вr1, Nа2S, Zn2О2, S2О6.
Завдання 6.
Заповніть таблицю формулами сполук вказаних елементів:
|
|
Н |
К |
Ва |
Аl |
|
О |
|
|
|
|
|
Сl (І) |
|
|
|
|
|
S (ІІ) |
|
|
|
|
![]() Як дати назву бінарній сполуці.
Як дати назву бінарній сполуці.
1. Назва бінарної сполуки утворюється з повної назви першого елемента та першого складу назви другого елемента з додаванням закінчення –ид (-ід).
Наприклад: Nа2О – натрій оксид, Аl2S3 – алюміній сульфід, КСl – калій хлорид.
2. Виключенням з цього правила є назви бінарних сполук у яких на першому місці записано символ Гідрогену. Ці сполуки, як правило, відносяться до класу кислот і їх назви утворюються в інший спосіб.
3. Якщо елемент має змінну валентність, її обов’язково зазначають після назви цього елемента у дужках римськими цифрами.
Наприклад: СО – карбон (ІІ) оксид; СО2 – карбон (ІV) оксид.
Домашня робота.
1. Що таке валентність хімічних елементів? Як скласти формули бінарних сполук за валентністю?
2. Встановіть відповідність.
а) мають постійну валентність –
б) мають змінну валентність –
1) Гідроген, 2) Оксисен, 3) Ферум, 4) Калій, 5) Кальцій, 6) Карбон
Зазначте можливі значення валентності кожного з цих елементів.
3. Складіть формули за валентністю :
III VI IV VI ІV
а) Р Сl , Zn О , Са Сl , S О , С О , Мg Br , Сr O , Аg Cl , Аl О , С Н
V III IV VI II
б) Н Сl , N О , Sі Н , Н Вr , Аl О , Р О , S О , S О , Fе Br, Zn Вr.
VIII VII III II IV V II III
в) Os O , I O , Mg Cl , N H , C O , C O , P Cl , K O , H S , Fe O.
4. Запишіть формули бінарних сполук за їх назвами: натрій хлорид, натрій оксид, ферум (ІІ) хлорид, ферум (ІІІ) хлорид, алюміній оксид, купрум (ІІ) оксид, магній нітрид, натрій сульфід, карбон (ІІ) оксид.
Тема 12. Визначення валентності за формулами бінарних сполук
Завдання:
- навчитися визначати валентність елементів за формулами бінарних сполук
- удосконалити вміння складати формули сполук за валентністю.
Визначення валентності елемента за формулою бінарної сполуки
|
№ |
Послідовність дій |
Приклад |
|
1. |
Відому валентність записуємо над формулою елемента зі сталою валентністю |
ІІ ІІ І ІІІ СО СО2 СН4 Аl4С3 |
|
2. |
Множимо сталу валентність на індекс цього елемента і ділимо на індекс елемента, валентність якого визначаємо ! Якщо індекс не проставлений, він дорівнює одиниці |
2×1:1=2 2×2:1=4 1×4:1=4 3×4:3=4 |
|
3. |
Записуємо визначену валент-ність римськими цифрами над символом елемента, валентність якого визначали |
II ІІ IV ІІ IV І ІІІ IV СО СО2 СН4 Аl4С3 |
|
4. |
Перевіряємо правильність виз-начення валентності, знаючи, що суми валентностей елементів у бінарній сполуці – рівні. |
II ІІ IV ІІ IV І ІІІ IV СО СО2 СН4 Аl4С3 2×1=2×1 4×1=2×2 4×1=1×4 3×4=4×3 |
Завдання 1.
Визначте валентність елементів у сполуках:
а) АgВr,ССl4, МgО, РbІ2, Fе2О3, НІ, WО3, МnО2, К2О, Н2S
б) Сr2О3, МnСl4, SО2, SО3, NН3, КСl, Р2О3, Р2О5, SіН4
Завдання 2.
Випишіть елементи, які в наведених сполуках є чотиривалентними:
К2О, НВr, NН3, Fе2О3, СаО, МnО2, Р2О5, NО2, СН4, Сl2О7, НСl, Сr2О3
Завдання 3.
Напишіть формули сполук елементів з Оксигеном, визначивши попередньо їх валентність у хлоридах:
FeCl2, FeCl3, CCl4, PCl5, SCl6, MnCl2.
Завдання 4.
Складіть формули оксидів і хлоридів калію, барію, цинку, алюмінію, хрому (ІІІ), фосфору (V).
Домашня робота.
1. У якому оксиді валентність елементу найвища?
а) СО; б) Nа2О; в) WО3; г) N2О
2. Визначте валентність елементів у сполуках:
Н2S, СаО, Nа2О, ВаСl2,SО3, СО, СО2, N2О3, НВr, АlСl3, РСl5, ТіСl4.
Назвіть ці сполуки (окрім Н2S і НВr).
3. Напишіть формули хлоридів металів, попередньо визначивши їх валентність у оксидах:
CuO, Cu2O, Fe2O3, FeO, PbO, PbO2, BaO, Li2O.
Зазначте назви сполук.
4*. Визначте валентність елементів у формулах тринарних сполук, знаючи, що сума одиниць валентності перших двох елементів дорівнює сумі одиниць валентності атомів Оксигену.
Н2SО4, СаСО3, Nа2SіО3, СuSО4, НСlО, НСlО4.
Тема 13. Узагальнення та систематизація знань з теми «Початкові хімічні поняття»
Завдання:
- узагальнити та систематизувати матеріал вивченої теми
Початковий рівень.
1. Хімія – це наука, яка вивчає:
а) хімічне виробництво;
б) речовини, їх будову та взаємні перетворення;
в) природні та штучні суміші.
2. У наведеному переліку: ложка, магній, залізо, молоток, золото, вода, айсберг – більше:
а) тіл; б) речовин; в) тіл і речовин порівну.
3. Встановіть відповідність між хімічними символами та їх вимовою:
а) Рb – б) S – в) С – в) Р –
1) ес; 2) це; 3) пе; 4) плюмбум.
4. Складні речовини містять:
а) атоми одного виду; б) атоми різних видів.
5. Вкажіть ряд, у якому більше знаків хімічних елементів-металів:
а) Мg, S, Zn, Nа, С; б) Сu, Fе, Р, F, Сl.
6. Молекула кисню позначається: а) О; б) 2О; в) О2; г) 2О2.
Середній рівень
1. Які фізичні властивості характерні для алюмінію?
а) добре розчинний у воді; б) добре проводить електричний струм;
в) має металевий блиск; г) має сріблясто-білий колір.
2. Визначте, які з перерахованих елементів відносяться до металів:
1) залізо; 2) натрій; 3) хлор; 4) сірка.
3. Запис СН4 означає, що це молекула складної речовини, до складу якої входять:
а) одна молекула Карбону і чотири молекули Гідрогену;
б) один атом Карбону і чотири атоми Гідрогену.
4. До складних речовин належать:
а) азот (N2);
б) питна сода (NаНСО3);
в) озон (О3);
г) цукор (С12Н22О11);
д) залізо (Fе);
е) сірководень (Н2S).
5. Встановіть відповідність:
а) мають постійну валентність – б) мають змінну валентність –
1) Цинк; 2) Ферум; 3) Натрій; 4) Гідроген.
6. Яка формула складена неправильно?
А) Nа2О; б) Са2О; в) ВаО.
Достатній рівень
1. Зазначте серед наведених речовин: а) прості речовини-метали; б) прості речовини-неметали; в) складні речовини.
Кисень (О2); вода (Н2О); вуглекислий газ (СО2); мідь (Сu); азот (N2); метан (СН4).
2. Запишіть за допомогою хімічних символів, індексів та коефіцієнтів:
а) 3 атоми Сульфуру;
б) 12 молекул кисню;
в) 4 атоми Гідрогену;
г) 3 молекули води.
3. Хімічна формула питної соди – NаНСО3. Яку інформацію ви можете отримати з цієї формули?
4. Чим пояснити, що кисень – О2 і озон – О3 мають різні властивості, хоча складаються з атомів Оксигену?
5. Визначте валентність атомів елементів у сполуках:
K2S, P2O5, Р2О3, Fe2O3, FeО, PH3, MnO2, Mn2O7, SiH4.
6. Складіть формули оксидів і хлоридів калію, кальцію, цинку, алюмінію, хрому (ІІІ), фосфору (V).
Високий рівень
1. Розмісти поняття «молекула», «атом», «тіло», «речовина», у логічній послідовності, так, щоб кожен елемент був структурною частинкою для будівництва наступного. Наведіть конкретний приклад такої послідовності.
2. Відомі два оксиди карбону: чадний газ – СО та вуглекислий газ – СО2. Як пояснити існування двох оксидів одного елемента? Як можна пояснити, що ці речовини мають різні властивості?
3. У склянках без етикеток містяться залізо, мідь, графіт, сірка. За якими ознаками можна їх розпізнати? Чим пояснюється відмінність у властивостях цих речовин? Запишіть їх хімічні формули. За якими ознаками ці речовини можна об’єднати в одну групу?
4. Порівняйте якісний та кількісний склад нітратної кислоти – НNО3 та сульфатної кислоти – Н2SО4. За якими ознаками можна об’єднати ці речовини в одну групу? Чим вони відрізняються?
5. Знаючи, що Нітроген проявляє валентність від І до ІV включно, складіть формули оксидів Нітрогену, назвіть їх.
6. Учень написав слідуючі формули елементів:
CF3, MgP, AlH3, ZnS, P2O5, FeO3. Поясніть, які з формул написані вірно, а які – невірно. Запишіть вірно усі формули та дайте назви речовинам.
Тема 14. Відносна молекулярна маса речовини, її обчислення за хімічною формулою
Завдання:
- вміти обчислювати відносну молекулярну масу речовини за її формулою
-
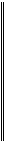 Мr – відносна молекулярна маса
Мr – відносна молекулярна маса
Мr – сума Аr усіх елементів, що входять до складу молекули.
Наприклад : Мr (Н2О) = 12+16 = 18
Мr (СаСО3) = 40+12+163 = 100
Мr (Н2SО4) = 12+32+164 = 98
Мr (Аl2О3) = 272+163 = 102
Мr (Fе(ОН)3) = 56+(16+1)3 = 107
Завдання 1.
Обчисліть відносні молекулярні маси речовин, формули яких:
а) Н2, О2, Сl2, N2; б) НF, СuО, СН4, НСN;
Завдання 2.
Обчисліть відносні молекулярні маси речовин, формули яких:
а) Р2О5, Н2SО4, КОН; б) NН3, NаОН, СuSО4;
Завдання 3.
Обчисліть відносні молекулярні маси речовин, формули яких:
а) Мg(NО3)2, Са3(РО4)2, СuSО4·5Н2О;
б) СО(NН2)2, Fе(ОН)3, КСl·МgСl2·6Н2О
Завдання 4.
Розставте речовини в порядку зростання їх молекулярних мас: О2, Н2S, NН3, СН4, СО, N2О.
Завдання 5.
Що важче й у скільки разів?
а) молекула водню Н2 чи молекула вуглекислого газу СО2;
б) дві молекули метану СН4 чи молекула сірчистого газу SО2.
Завдання 6.
Напишіть хімічну формулу й обчисліть відносну молекулярну масу сполуки, молекула якої складається з:
а) шести атомів Карбону, дванадцяти атомів Гідрогену, шести атомів Оксигену (глюкоза);
б) шести атомів Карбону, восьми атомів Гідрогену, шести атомів Оксигену (аскорбінова кислота – вітамін С).
Домашня робота.
1. Обчисліть відносні молекулярні маси речовин, формули яких:
а) СuО, К2О, СО2;
б) Аl2О3, N2О5, Н2SО4;
в) Сu(NО3)2, Аl2(SО4)3, Nа2СО3·10Н2О.
2. Визначте, у скільки разів відносна молекулярна маса першої речовини у кожній парі більша або менша від відносної молекулярної маси другої речовини:
а) озон О3 – кисень О2;
б) азот Н2 – етилен С2Н4;
в) аміак NН3 – сірководень Н2S.
3. Напишіть хімічну формулу й обчисліть відносну молекулярну масу сполуки, молекула якої складається з:
а) двох атомів Карбону, шести атомів Гідрогену, одного атома Оксигену (етиловий або винний спирт);
б) двох атомів Карбону, чотирьох атомі Гідрогену, двох атомів Оксигену (оцтова кислота).
4*. Визначте хімічну формулу мінералу берилу, однією з різновидностей якого є дорогоцінний смарагд, якщо відомо, що молекула берилу складається з двох атомів Алюмінію, трьох атомів невідомого елемента, шести атомів Силіцію, вісімнадцяти атомів Оксигену, а відносна молекулярна маса берилу становить 537.
тема 15. Масова частка елемента в речовині
Завдання:
- вміти обчислювати масову частку елемента в речовині
-
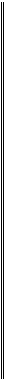 W – масова частка елемента
W – масова частка елемента
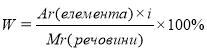 , де
, де
Аr(елемента) – відносна атомна маса елемента ,
і – індекс (кількість атомів елемента, що входять до складу молекули),
Мr(речовини) – відносна молекулярна маса речовини.
Задача.
Визначте масові частки Гідрогену й Оксигену у складі води.
|
Н2О
W(О) - ?%
|
Розв’язання:
Мr ( Н2О ) = 12+16 = 18
W(О) ≈ 100% - 11% |
Відповідь: W(Н) ≈ 11%, W(О) ≈ 99%.
Завдання 1.
Випишіть і вивчіть формулу, за якою обчислюють масову частку елемента в речовині.
Завдання 2.
Обчисліть масові частки елементів у :
а) метані – СН4; б) сірчистому газі – SО2; в) крейді – СаСО3.
Завдання 3.
Розв’яжіть задачі.
1) масова частка Оксигену у натрій оксиді (Nа2О) дорівнює:
а) 32 %; б) 50,2 %; в) 25,8 %.
2) масова частка Магнію у магній оксиді (MgО) дорівнює:
а) 40 % б) 35 % в) 60 %.
Завдання 4.
Хімічним аналізом установлено, що у зразку купрум (ІІ) оксиду СuО масова частка Купруму становить 70%. Чи є взятий зразок чистою речовиною? Відповідь дайте на підставі розрахунків.
Завдання 5.
Визначте, яка руда є більш вигідною для одержання заліза:
магнітний залізняк – Fе3О4;
червоний залізняк – Fе2О3;
бурий залізняк – 2Fе2О3·3Н2О;
пірит – FеS2.
Завдання 6.
Яке з азотних добрив: натрієва селітра – NаNО3, чи аміачна селітра – NН4NО3 містить більший відсоток елементу живлення?
Домашня робота.
1. Визначте масову частку Оксигену в:
а) кремнеземі (пісок) – SіО2;
б) алюміній оксиді (глина) – Аl2О3;
в) гідроген пероксиді – Н2О2.
2. Молекула фосфатної кислоти складається з трьох атомів Гідрогену, одного атома Фосфору та чотирьох атомів Оксигену. Напишіть хімічну формулу фосфатної кислоти і визначте масові частки кожного з елементів.
3. Молекула сульфатної кислоти містить два атоми Гідрогену, один атом Сульфуру та чотири атоми Оксигену. Напишіть хімічну формулу сульфатної кислоти і визначте масові частки кожного з елементів.
4*. Хімічним аналізом установлено, що у зразку мідного купоросу СuSО4·5Н2О масова частка Купруму становить 24%. Чи є взятий зразок чистою речовиною? Відповідь дайте на підставі розрахунків.
тема 16. Фізичні та хімічні явища
Завдання:
- вміти наводити приклади хімічних явищ у природі та побуті;
- вміти розрізняти фізичні та хімічні явища
![]() Будь-які зміни, що відбуваються в природі, називаються явищами.
Будь-які зміни, що відбуваються в природі, називаються явищами.
Фізичні явища не приводять до зміни молекул речовини.
Хімічні явища – це явища, у результаті яких відбувається перетворення речовин. Хімічні явища інакше називають хімічними реакціями.
Сутність хімічної реакції полягає в перегрупуванні атомів.
Ознаки хімічних реакцій:
1. Виділення світла та тепла .
2. Зміна кольору.
3. Випадання осаду.
4. Виділення газу.
Умови виникнення та перебігу хімічних реакцій.
1. Зіткнення речовин (зливання розчинів, подрібнення та перемішування твердих речовин).
2. Температура, достатньо висока для перебігу реакції.
![]() Завдання 1.
Завдання 1.
Фізичним чи хімічним явищем є: а) горіння сірника; б) танення снігу? Відповідь поясніть.
Завдання 2.
Запишіть, як називаються процеси зміни агрегатного стану речовини, наведіть конкретні приклади таких змін. Про які явища йде мова: фізичні чи хімічні? Чому?

![]()
![]()
![]()
![]()
![]()
![]()
![]()
Для довідки: плавлення, випаровування, сублімація, конденсація, тверднення.
Завдання 3.
Серед явищ, які відбуваються в природі та в побуті, визначте фізичні та хімічні, запишіть їх у дві колонки. Вкажіть ознаки хімічних реакцій, виписаних вами.
Розчинення цукру у воді, прокисання молока, утворення інею, іржавіння цвяхів, добування крохмалю з картоплі, утворення роси, відбілювання тканини, танення льоду, замерзання води, горіння сірника, висихання глини, розчинення йоду в спирті, посиніння крохмалю під дією йоду, згіркнення масла з часом, бродіння виноградного соку.
Завдання 4.
Які ознаки супроводжують наступні хімічні явища:
а) «гасіння» соди оцтом (реакція оцтової кислоти з натрій гідрогенкарбонатом); б) горіння свічки; в) згіркнення масла з часом; г) прокисання молока.
Завдання 5.
Під час дихання кисень, який вдихає людина, перетворюється на вуглекислий газ, який вона видихає. Чи свідчить це про те, що в організмі людини відбуваються хімічні реакції? Які ознаки цих реакцій?
Завдання 6.
Заповніть таблицю, вписавши у неї наступні фізичні та хімічні явища: горіння дров, пожовтіння листя, кипіння води, відстоювання суміші глини і води, блискавка, райдуга, фотосинтез, утворення накипу в чайнику.
|
Ознаки явищ |
Фізичні явища |
Хімічні явища |
|
Виділення світла та тепла |
|
|
|
Випадання осаду |
|
|
|
Виділення газу |
|
|
|
Зміна кольору |
|
|
Чи можна лише за зовнішніми ознаками відрізнити фізичне явище від хімічного? У чому, на вашу думку, полягає найважливіша відмінність фізичних та хімічних явищ?
Домашня робота.
1. Яка головна відмінність хімічних явищ від фізичних? Наведіть приклади фізичних та хімічних явищ, які відбуваються в природі та в господарстві. Які з цих явищ використовуються людиною?
2. Визначте, які з явищ, що відбуваються в живій і неживій природі відносяться до хімічних, а які – до фізичних?
а) утворення хмар;
б) фотосинтез;
в) випаровування води;
г) грім і блискавка?
д) вивітрювання гірських порід;
е) дихання;
є) ґрунтотворення.
3. Які з перелічених явищ належать до хімічних і чому:
а) кування металів;
б) приготування їжі;
в) засахарювання варення;
г) утворення солі при випарюванні морської води;
д) протухання курячого яйця;
е) утворення сніжинок;
є) горіння спирту?
4. Природний газ, метан СН4 який використовується і в газових плитах, і газових котлах, згорає в присутності кисню О2 з утворенням вуглекислого газу СО2 та води Н2О. Чи можуть утворитися ці речовини при нагріванні метану до високої температури без доступу кисню? Які відомі вам речовини можуть утворитися за цих умов? Які ознаки матиме дана хімічна реакція? Якщо ви вірно відповіли на попередні запитання, то зможете пояснити, чому посуд, який використовується для приготування їжі, часто має закопчене дно, чому стелю на кухні білять частіше, ніж у інших приміщеннях, а з газових котлів періодично вичищають сажу.
Дослід 1.
Явище сублімації – переходу твердої речовини в газоподібний стан у природі можна спостерігати не так часто. Воно відбувається, наприклад, при вимерзанні білизни на морозі. Дуже красиво виглядає сублімація йоду. Для цього кристалик йоду покладіть на скельце і нагрійте його на полум’ї. Спостерігається виділення парів йоду фіалкового кольору. Увага! Пари йоду небезпечні, вони можуть викликати опіки шкіри та слизистих оболонок, тому дослід слід проводити під тягою або на відкритому повітрі. Невелику кількість кристалічного йоду ви можете добути випарувавши кілька краплин спиртового розчину йоду на відкритому повітрі, або додавши до спиртового розчину йоду перекис водню, який зменшує його розчинність. Опишіть хід досліду та власні спостереження.
Дослід 2.
Здатність речовин реагувати між собою, утворюючи забарвлені продукти реакції, використовують для визначення цих речовин. Наприклад, крохмаль реагує з йодом з утворенням речовини синього кольору. Нанесіть краплину спиртового розчину йоду (продається в аптеці) на шматочки хліба, картоплі, зеленого та стиглого яблука, моркви, цибулі, інших овочів та фруктів, які є у вас вдома. Поява синього забарвлення свідчить про те, що досліджувані продукти містять крохмаль. Результати експерименту оформіть у вигляді таблиці, в якій зазначте назву досліджуваного продукту, результат реакції з йодом, висновок про вміст крохмалю у даному продукті.
Дослід 3.
Здатність йоду реагувати з деякими продуктами харчування з утворенням забарвлених сполук дозволить вам перевірити чи гарно ви чистите зуби. Для цього розбавте спиртовий розчин йоду водою до жовтого кольору (розчин бурого кольору може викликати опіки слизистої оболонки ясен!) та за допомогою ватки, намотаної на сірник, нанесіть його на зуби та ясна. Йод не реагує з зубною емаллю і не змінює її колір. А от якщо на зубах та яснах залишилися мікроскопічні залишки їжі, йод забарвить їх в темний колір. Отже, якщо ватка, вмочена в розбавлений розчин йоду, залишає темні сліди на зубах, вони почищені погано, тому що на них залишилися частинки їжі. Опишіть хід досліду. Чи відомі вам інші приклади використання хімічних явищ в медицині?
Дослід 4.
Виділення газу в ході хімічної реакції спостерігається в тому випадку, коли хоча б один з продуктів реакції є газом. Такі реакції можна проробити вдома.
Змішайте пів чайної ложки питної соди та столову ложку оцтової кислоти (столового оцту). Що спостерігаєте? Розчиніть питну соду в теплій воді та поставте на водяну баню. Що спостерігаєте? Які умови необхідні для перебігу реакції в першому та другому випадку? Які ознаки цих реакцій? Опишіть хід досліду.
Тема 17. Фізичні й хімічні властивості речовини
![]() Речовина має сукупність властивостей, за якими вона відрізняється від іншої речовини або подібна до неї.
Речовина має сукупність властивостей, за якими вона відрізняється від іншої речовини або подібна до неї.
Фізичні властивості допомагають розпізнати речовини, відрізнити одні речовини від інших. Виявлення та вимірювання фізичних властивостей речовини не вимагає перетворення речовини на іншу.
Хімічні властивості речовини – здатність речовини вступати в певні хімічні реакції, перетворюватися на інші речовини.
Завдання 1.
Фізичні чи хімічні властивості речовин характеризують:
а) температура плавлення;
б) здатність горіти;
в) електропровідність;
г) розкладання при нагріванні;
д) здатність реагувати з водою;
е) здатність розчинятися у воді;
є) колір;
ж) пластичність.
Завдання 2.
Серед нижченаведених явищ визначте фізичні та хімічні явища:
а) зимою вода в річці замерзає;
б) із скла виготовляють скляний посуд;
в) повітря розділяють на кисень і азот;
г) з нафти добувають гуму;
д) кисень підтримує горіння;
е) з молока отримують сир;
є) восени листя жовкне;
ж) залізо іржавіє.
Завдання3.
Більшість металів, крім благородних: срібло, золото, платина, та деяких інших, на повітрі поступово вкриваються шаром оксиду. Яка це властивість металів: фізична чи хімічна?
Завдання4.
За якими фізичними властивостями є подібними: а) парафін і олія; б) мідь і залізо; в) пісок і кухонна сіль. Які властивості дозволяють розрізнити ці речовини?
Завдання5.
Івасик переконаний, що хімія має вивчати виключно хімічні властивості речовин, а Оленка вважає, що дослідження хімічних властивостей речовин неможливе без знання їх фізичних властивостей. А як думаєте ви? Відповідь поясніть.
Завдання 6.
Як ви розумієте значення хімічних реакцій у житті суспільства. В чому їх суперечливий характер?
Домашня робота.
1. У склянці є чиста вода. За якими ознаками можна довести, що ця рідина – саме вода, а не, скажімо, кислота, бензин чи олія?
2. У склянках без етикеток містяться олія, оцтова кислота, шматочки заліза, мармуру, графіту, кухонна сіль. За якими властивостями можна визначити кожну з речовин?
3. Знайдіть удома зразки виробів з різних металів (алюмінієвий та мідний дріт, вкрита оловом консервна банка, золота обручка, вольфрамова спіраль електричної лампи тощо). Опишіть фізичні властивості металів. Чи завжди можна розрізнити метали за їх зовнішнім виглядом? Яка фізична властивість дозволяє досить точно розрізняти різні метали?
4. Розчин калій перманганату (марганцівки), приготований для дезінфекції, повністю не використали і залишили на слідуючий день. Проте наступного дня виявилося, що колись рожевий розчин знебарвився, а на дні склянки, в якій він зберігався, з'явився бурий осад. Як ви гадаєте, з чим можуть бути пов’язані зміни розчину? Чи можна його використовувати для дезінфекції? Сплануйте та проведіть дослід, про який йшла мова в завданні. Опишіть хід досліду.
Дослід 1.
Опишіть фізичні властивості речовин, з якими ви зустрічаєтеся в повсякденному житті, заповніть таблицю:
|
Фізичні власти-вості речовин |
Скло |
Олія
|
Парафін |
Крейда |
Кухонна сіль |
Оцет |
|
1. Агрегатний стан* |
|
|
|
|
|
|
|
2. Колір |
|
|
|
|
|
|
|
3. Запах |
|
|
|
|
|
|
|
4.Розчинність у воді |
|
|
|
|
|
|
|
5. Зміни при нагріванні |
|
|
|
|
|
|
*Для твердих речовин вкажіть характер часточок (кристали, порошок).
Для кожної речовини вкажіть одну-дві характерні ознаки, за якими її можна відрізнити від усіх інших. З якими фізичними або хімічними властивостями цих речовин пов'язане їх застосування?
Дослід 2.
Налийте в чайник склянку води. Нагрійте її до кипіння. Що спостерігаєте? Чи утворилася нова речовина? Яке це явище: фізичне чи хімічне? Після закипання води потримайте над парою, яка виходить з носика чайника, холодну тарілку. Що спостерігаєте? Чи утворилася нова речовина? Яке це явище: фізичне чи хімічне?
Дослід 3.
Налийте півсклянки теплої води та розчиніть у ній столову ложку цукру. Що спостерігаєте? Чи утворилася нова речовина? Яке це явище: фізичне чи хімічне? Вилийте кілька краплин розчину цукру на тарілку та залиште в теплому місці поки випарується вода. Що спостерігаєте? Чи утворилася нова речовина? Яке це явище: фізичне чи хімічне?
Дослід 4.
Налийте півсклянки теплого молока та опустіть у нього шматочок чорного хліба. Залиште молоко на добу в теплому місці. Що спостерігаєте? Чи утворилася нова речовина? Яке це явище: фізичне чи хімічне? Опишіть умови та ознаки перебігу реакції.
Дослід 5.
Наберіть у столову ложку трохи цукру. Візьміть ложку кухонною рукавичкою та нагрівайте цукор до видимих змін. Що спостерігаєте? Чи утворилася нова речовина? Яке це явище: фізичне чи хімічне? Опишіть умови та ознаки перебігу реакції.
Дослід 6.
Проведіть два досліди: горіння стеаринової свічки та плавлення стеарину. Порівняйте умови перебігу цих явищ, свої спостереження. Поясніть, чому одне з цих явищ відноситься до хімічних, а інше – до фізичних? У чому найважливіша відмінність фізичних явищ від хімічних?
Тема 18. Практична робота 2. Дослідження фізичних і хімічних явищ
Завдання:
- вміти спостерігати хімічні явища й описувати спостереження,
- вміти формулювати висновки;
- дотримуватися правил ТБ при роботі в кабінеті хімії.
Обладнання: пробірки, штатив для пробірок, скляні палички, стаканчик з водою, спиртівка, сірники, свічка, калій перманганат, лимон, цукор, крейда, розчини хлоридної кислоти, натрій гідроксиду, мідного купоросу.
Завдання 1. Закінчіть речення:
1. Явища, під час яких речовини залишаються незмінним називають ___.
2. Явища, за яких відбувається перетворення одних речовин на інші називають ___ , або ___.
3. До якого виду явищ: фізичних чи хімічних належать:
а) кипіння води;
б) розкладання води на водень і кисень;
в) іржавіння заліза;
г) плавлення заліза.
Завдання 2. Порівняння фізичних і хімічних явищ.
|
№ |
Дослід |
Спостере- женя (що відбулося?) |
Висновки (чи ут-ворилася нова ре-човина? Яке це явище: фізичне чи хімічне?) |
|
1 |
Розплавте декілька шматочків стеарину у пробірці. Вилийте розплав на скляну пластинку. |
|
|
|
2 |
Підпаліть стеаринову свічку. Над полум’ям потримайте холодну скляну пластинку. |
|
|
|
3 |
До рожевого розчину калій перманганату додайте кілька крапель лимонного соку |
|
|
|
4 |
Розчиніть цукор у стаканчику з водою |
|
|
Яка найважливіша відмінність фізичних явищ від хімічних?
Завдання 3. Визначення ознак хімічних реакцій
|
№ |
Дослід |
Спостере-ження (що відбулося?) |
Висновки (які ознаки свідчать про те, що відбулася хімічна реакція?) |
|
1 |
До розчину NаОН додайте фенолфталеїн |
|
|
|
2 |
До порошку крейди СаСО3 додайте розчин НСl |
|
|
|
3 |
Змішайте розчини CuSO4 і NаОН |
|
|
|
4 |
Підпаліть сірник |
|
|
Які ознаки можуть супроводжувати хімічні реакції?
Завдання 4.
Зробіть висновок, у якому зазначте:
а) Які явища називають фізичними? Які явища називають хімічними?
б) У чому полягає найважливіша відмінність фізичних та хімічних явищ?
в) За якими ознаками можна судити, що відбулася хімічна реакція?
г) Чи можна лише за зовнішніми ознаками відрізнити фізичне явище від хімічного?
Домашня робота.
1. Наведіть приклади фізичних і хімічних явищ, що відбуваються в природі та і побуті.
2. Запишіть формули сполук, які можуть утворитися в результаті хімічної реакції між:
а) алюмінієм і киснем;
б) воднем і хлором;
в) вуглецем і воднем (Карбон у сполуці з Гідрогеном чотиривалентний);
г) натрієм і сіркою (Сульфур у сполуках з металами завжди двовалентний);
д) сіркою і киснем (Сульфур може проявляти валентність 4 або 6).
3. Виявіть ознаки, які свідчать про перебіг хімічних реакцій в природі та в побуті. Наведіть приклади цих реакцій.
4*. Підготуйте повідомлення: «Михайло Васильович Ломоносов».
Домашні досліди.
Проведіть удома наступні хімічні реакції (досліди проводьте лише у присутності дорослих!), опишіть хід дослідів:
1. Розкладання харчової соди при нагріванні. Для цього чайну ложку харчової соди слід помістити в склянку, до половини наповнену гарячою водою;
2. Окиснення міді киснем повітря. Для цього мідну пластинку або дріт слід потримати у полум’ї.
3. Реакцію між купрум (ІІ) оксидом та оцтовою кислотою. Для цього почорнілу пластинку або мідну дротинку з попереднього досліду опустіть в прозору склянку на дно якої налито трохи оцтової кислоти. Реакція ця йде досить повільно;
4. Реакцію між оцтовою кислотою та алюмінієвим дротом. У склянку з оцтовою кислотою помістіть зачищений наждачним папером алюмінієвий дріт. Реакцію можна прискорити, помістивши у ту ж склянку ще й шматок мідної дротини;
5. Розкладання гідроген пероксиду. Для цього гідроген пероксид (він продається в аптеці під назвою перекис водню) налийте у прозору посудину, спостерігайте виділення бульбашок газу. Реакцію можна прискорити. Зігрійте посудину в долоні. Що спостерігаєте? Вкиньте в посудину шматочок сирого м’яса або розтертий листок рослини. Опишіть спостереження.
6. Знебарвлення марганцівки під дією кислоти. Розчиніть у воді кілька кристалів марганцівки (калій перманганату), щоб розчин набув рожевого кольору та вичавте у нього трохи лимонного соку. Що спостерігаєте? Проведіть дослід іще раз, але замість лимонного соку, додайте до розчину марганцівки столову ложку оцту.
Тема 19. Закон збереження маси речовини
Завдання:
- вміти пояснювати сутність закону збереження маси речовини.
![]() У 1748 році М. В. Ломоносов відкрив закон збереження маси речовини.
У 1748 році М. В. Ломоносов відкрив закон збереження маси речовини.
У 1789 році Антуан Лавуазьє дав сучасне формулювання цього закону: «Загальна маса речовин, які вступили в хімічну реакцію, дорівнює загальній масі речовин, які утворилися в результаті реакції».
Іншими словами, маса реагентів дорівнює масі продуктів реакції.
Реагенти → Продукти реакції
(речовини, що вступають (речовини, що утворюються
в реакцію) внаслідок реакції)
Завдання 1.
Запишіть схеми реакцій, які відбуваються при проведенні дослідів. Визначте в них реагуючі речовини та продукти реакції.
Дослід 1. Мідну пластинку прожарили у полум’ї. Унаслідок реакції міді з киснем (О2) поверхня пластинки вкрилася чорним нальотом. Це утворився купрум (ІІ) оксид – СuО.
Дослід 2. Пластинку з чорним нальотом СuО опустили в хлоридну кислоту НСl. Поступово наліт зник, а розчин став зеленкувато-блакитним, тому що утворився купрум (ІІ) хлорид – СuСl2. Яка ще речовина утворилася в результаті реакції?
Дослід 3. У отриманий розчин СuСl2 опустили залізний цвях. Поступово поверхня цвяха вкрилася шаром міді, а розчин став зеленкуватим, бо замість СuСl2 він містить тепер FеСl2.
Завдання 2.
Горіння багатьох органічних речовин (папір, деревина, віск, спирт тощо) описується слідкуючою схемою:
органічна речовина + кисень → вуглекислий газ + водяна пара
реагенти продукти реакції
Виходячи з цієї схеми, доведіть, що маса диму більша за масу дров, які згоріли.
Завдання 3.
За допомогою хімічних формул запишіть схеми наступних реакцій:
а) залізо + сірка → ферум (ІІ) сульфід;
б) натрій + водень → натрій гідрид;
в) алюміній + кисень → алюміній оксид;
г) кальцій карбонат → кальцій оксид + вуглекислий газ
Увага! Молекули кисню і водню – двохатомні. Їх формули: О2, Н2.
Завдання 4.
Закінчіть схеми реакцій. Формули складних речовин записуйте за валентністю.
Мg + О2→
Аl + Сl2→
Р + О2→
Н2+ Сl2→
Nа + S→
Аl + О2→
Завдання 4.
Під час розкладання меркурій (ІІ) оксиду HgO масою 4,34 г отримали 4,02 г ртуті. Яку масу кисню отримали при цьому? Запишіть схему реакції.
Завдання 5.
Після спалювання 4,8 г магнію отримали 8 г магній оксиду. Яка маса кисню, що сполучився з магнієм? Запишіть схему реакції.
Завдання 6.
Свічка в процесі горіння зменшується за розміром і масою і врешті-решт зникає. Як треба поставити дослід, щоб довести дію закону збереження маси речовини в цьому випадку?
Домашня робота.
1. Ким і коли було відкрито закон збереження маси речовини? Як він формулюється? Який дослід дозволив відкрити закон збереження маси? Замалюйте схему приладу для проведення такого досліду.
2. При розкладанні меркурій (ІІ) оксиду було отримано 20,1 г ртуті і 1,6 г кисню. Яка маса меркурій (ІІ) оксиду розклалася? Запишіть схему реакції.
3. Мідь прожарили на повітрі, так, що вона повністю окислилася, перетворившись на чорний порошок купрум (ІІ) оксиду СuО, цей порошок помістили в хлоридну кислоту НСl, унаслідок чого він перетворився на купрум (ІІ) хлорид СuСl2, що має зелений колір і є розчинним у воді, до даного розчину долили розчин натрій гідроксиду NаОН, який прореагував з купрум (ІІ) хлоридом з утворенням купрум (ІІ) гідроксиду Сu(ОН)2, нерозчинної речовини блакитного кольору. Осад купрум (ІІ) гідроксиду відфільтрували та прожарили, отримавши в результаті чорний порошок купрум (ІІ) оксиду. Цей порошок відновили воднем Н2 до металічної міді.
Запишіть схеми перетворень, які відбулися з міддю, спочатку словами, а потім за допомогою хімічних формул, сполучаючи вихідні речовини та продукти реакцій стрілками: →. Поясніть, як співвідносяться маси міді, яка вступила в реакцію, та міді, яка утворилася в результаті всіх цих перетворень. Відповідь поясніть.
4. Після спалювання паперу залишається значно менша маса попелу, а при прожарюванні міді – маса речовини зростатиме. Чи не суперечить це закону збереження маси речовини? Яким чином довести справедливість закону збереження маси речовин для даних процесів?
Тема 20. Хімічні рівняння
Завдання:
- вміти пояснювати зміст рівнянь хімічних реакцій;
- використовувати закон збереження маси речовини для складання рівнянь хімічних реакцій.
![]() Схема реакції – запис реакції за допомогою хімічних формул.
Схема реакції – запис реакції за допомогою хімічних формул.
Вугілля + кисень → вуглекислий газ
реагенти продукти реакції
С + О2 → СО2 – схема реакції горіння вугілля
Хімічне рівняння – умовний запис хімічної реакції за допомогою хімічних формул і коефіцієнтів.
У хімічному рівнянні обов’язково кількість атомів елемента до реакції дорівнює кількості атомів цього ж елемента після реакції.
Запис: С + О2 = СО2 є хімічним рівнянням, оскільки кількість атомів Карбону і Оксигену до і після реакції – рівні.
Запис: Н2 + О2 → Н2О є схемою хімічної реакції, проте не є хімічним рівнянням, оскільки не урівняна кількість атомів Оксигену. Урівняти можна за допомогою коефіцієнтів:
2Н2 + О2 = 2Н2О – рівняння реакції.
Завдання 1.
Запишіть схеми таких реакцій:
а) вугілля + водень → метан (СН4);
б) мідь + кисень → купрум (ІІ) оксид;
в) алюміній + кисень → алюміній оксид;
г) кальцій карбонат → кальцій оксид + вуглекислий газ
Увага! Молекули кисню і водню – двохатомні: О2, Н2.
Завдання 2.
Чи є рівнянням реакції слідуючі записи:
а) S + О2 → SО2;
б) НgО →Нg + О2;
в) Мg + S →МgS;
г) Н2 + Сl2 →НСl.
Завдання 3.
Розставте коефіцієнти у схемах таких реакцій:
Аl + S →Аl2S3;
Nа + S → Nа2S;
Fе + О2 → Fе3О4.
Н2 + О2 → Н2О;
Н2 + Сl2 → НСl;
Са + О2 → СаО;
Завдання 4.
Розставте коефіцієнти у схемах реакцій і обчисліть їх суму у кожному складеному рівнянні:
Аg2О + Н2 → Аg + Н2О;
Fе2О3 + Н2 → Fе + Н2О;
Fе3О4 + Н2 → Fе + Н2О;
Сu2О + С → Сu + СО2
Сr2О3 + С → Сr + СО;
МоО3 + С → Мо + СО
Завдання 5.
Складіть формули продуктів реакцій і напишіть відповідні хімічні рівняння:
Аl + О2 → Аl_О_;
V
Р + О2 → Р_О_;
ІІІ
Мg + Р → Мg_Р_;
Lі + О2 → Lі_О_;
ІІІ
Sі + N2 → Sі_N_;
ІІІ
Мg + N2 → Мg_N_.
Завдання 6.
Складіть формули реагентів, продуктів реакцій і напишіть відповідні хімічні рівняння:
ІІ ІІІ
Fе_О_ + О2 → Fе_О_;
ІІ ІІІ
Fе_ Сl_ + Сl2 → Fе_Сl_;
VI ІІІ
Сr_О_ → Сr_О_ + О2
VII
Сl_О_ → Сl2 + О2
Домашня робота
1. Розставте коефіцієнти у схемах реакцій:
SО2 + О2 → SО3;
NО + О2 → NО2;
FеО + О2 → Fе2О3;
СО + О2 → СО2;
Сu2О + О2 → СuО ;
Ті2О3 + О2 → ТіО2.
2. Розставте коефіцієнти в схемах реакцій:
СаО + Аl → Са + Аl2О3;
Сr2О3 + Аl → Сr + Аl2О3;
ТіО2 + Аl → Ті + Аl2О3;
V2О5 + Са → V + СаО;
ТіО2 + Са → Ті + СаО;
МоО3 + Са → Мо + СаО.
3. Складіть формули реагентів, продуктів реакцій і напишіть відповідні хімічні рівняння
І
Nа + Сl2 → Nа_Сl_;
І
Са + Сl2 → Са_Сl_;
IV
С + F2 → С_F_;
V
Р + F2 → Р_F_;
ІІІ
N_Н_ + О2 → N2 + Н_О_;
II IV
H_S_+ О2 → S_О_+ Н_О_;
IV IV
С_Н_ + О2 → С_О_ + Н_О_
V II V IV
Р_S_ + О2 → Р_О_ + S_О_
Тема 21. Узагальнення та систематизація знань з теми «Початкові хімічні поняття»
Завдання:
- узагальнити та систематизувати матеріал вивченої теми.
Початковий рівень.
1. Танення льоду належить до: а) фізичних явищ; б) хімічних явищ.
2. Ознаки хімічної реакції:
а) зміна кольору; б) випадання осаду.
3. Відносна молекулярна маса це –
а) маса молекули в грамах; б) маса молекули в атомних одиницях маси; в) відношення маси молекули до 1/12 маси атома Карбону.
4. Встановіть правильну послідовність фрагментів, та сформулюйте закон збереження маси речовини:
1) дорівнює загальній масі продуктів реакції;
2) загальна маса речовин;
3) які вступили в хімічну реакцію.
5. Під час хімічних реакцій руйнуються: а) атоми; б) молекули; в) йони
6. Складіть рівняння реакції за схемою: Zn + О2 → ZnО.
Середній рівень
1. Яка відносна молекулярна маса сульфатної кислоти (Н2SО4)?
2. Яка відносна молекулярна маса алюміній сульфіду (Аl2S3)?
3. Складіть хімічні реакції за поданими схемами
а) С+ О2 → СО2
б) Zn +НСl → ZnСl2+Н2↑
в) Fе2О3 + Н2 → Fе + 3Н2О
г) Fе2О3+НСl → FеСl3+Н2О
4. Обчисліть масову частку Оксигену в кремнеземі (SіО2):
а) 53,3%; б) 26,6%; в) 36,4%; г) 72,7%.
5. Складіть рівняння реакцій відповідно до схем:
а) Mg +НСl→ MgСl2+Н2↑;
б) Аl+О2 → Аl2О3 ;
в) НgO → Нg + О2.
6. Фізичними, чи хімічними явищами є: а) вибух динаміту; б) скисання молока; в) тверднення розплавленого парафіну; г) підгорання їжі на сковороді; д) розчинення цукру у воді; е) утворення солі при випаровуванні морської води; є) спінення шампанського при відкриванні пляшки; ж) гниття рослинних залишків; з) випаровування бензину; и) проходження електричного струму через алюмінієвий дріт; і) вицвітання кольорової тканини на сонці.
Достатній рівень.
1. Молекула сахарози складається з 12 атомів Карбону, 22 атомів Гідрогену та 11 атомів Оксигену. Запишіть її хімічну формулу та обчисліть відносну молекулярну масу сахарози.
2. Хімічна формула питної соди NаНСО3. Визначте: а) якісний і кількісний склад речовини; б) відносну молекулярну масу питної соди; в) масову частку Натрію в питній соді.
3. На основі закону збереження маси речовини визначте склад невідомих речовин:
а) 2Н2 + ? = 2Н2О;
б) СаСО3 = СаО + ?;
в) 2Р + 5? = 2РСl5.
4. Сашко та Микола засперечалися. Сашко вважає, що при згоранні аркуша паперу утворюється дим, маса якого більша за масу аркуша, який згорів, а Микола вважає, що маса диму значно менша за масу аркуша. Хто з них правий? Відповідь поясніть.
5. Напишіть рівняння реакцій за такими схемами:
а) Zn + Н2SО4 → ZnSО4 + Н2
б) КМnО4 → К2МnО4 + МnО2 + О2
в) NаСl + Н2SО4 → Nа2SО4 + НСl
г) SО2 + О2 → SО3
д) Н2О2 → Н2О + О2
е) Fе + НСl → FеСl2+Н2
є) Fе(ОН)2 → FеО + Н2О
ж) Н2S + Сl2 → 2НСl + S
з) СаО + Н2О → Са(ОН)2
и) Fе(ОН)2 + Н2SО4 →FеSО4 + 2Н2О
6. Складіть формули за валентністю та напишіть рівняння реакції:
а) Lі+О2→
б) Аl+Сl2→
в) Mg+ О2→
г) Nа+S →
д) Аl+Вr2→
е) СО+О2→
є) Nа+Сl2→
ж) Н2 + О2 →
Високий рівень
1. При нагріванні плюмбум (ІІ) карбонату РbСО3 утворилося 22,3 г плюмбум (ІІ) оксиду і 4,4 г карбон (ІV) оксиду. Яка маса плюмбум (ІІ) карбонату розклалася? Складіть рівняння реакції.
2. Вставте в рівняннях хімічних реакцій пропущені формули та доберіть коефіцієнти:
а) Н2 + ? → НСl;
б) N2 + ? → NН3.
в) N2О5 + ? → НNО3;
г) NаНСО3 → Nа2СО3 + СО2 + ?;
3. Обчисліть масову частку кристалізаційної води в мідному купоросі CuSO4·5Н2О.
4. Чи може змінитися число атомів і число молекул під час:
а) фізичного явища; б) хімічного явища.
Відповідь аргументуйте.
5. Як маючи лише парафінову свічку та сірники продемонструвати
а) два фізичних явища
б) два хімічних явища
6. Поясніть, чому спроби алхіміків перетворити неблагородні метали на золото були приречені на невдачу, хоча вони провели величезну кількість різноманітних хімічних реакцій.
Тема 22. Оксиген. Кисень, склад його молекули, фізичні властивості, поширення в природі
Завдання:
- вміти називати склад молекул кисню;
- вміти характеризувати фізичні властивості кисню;
![]() План характеристики хімічного елемента
План характеристики хімічного елемента
1. Хімічний символ.
2. Відносна атомна маса.
3. Валентність.
4. Поширення елемента в природі.
План характеристики простої речовини.
1. Хімічна формула.
2. Відносна молекулярна маса.
3. Фізичні властивості.
4. Хімічні властивості.
5. Застосування.
6. Знаходження в природі.
7. Способи отримання в лабораторії і в промисловості.
Завдання 1.
Про кисень, чи про Оксиген йде мова в наступних твердженнях:
а) завжди двовалентний;
б) входить до складу піску, глини, крейди;
в) газ без кольору, запаху, смаку;
г) підтримує горіння;
д) входить до складу води;
е) малорозчинний у воді;
є) ми ним дихаємо;
ж) входить до складу повітря;
з) виділяється рослинами у процесі фотосинтезу.
Завдання 2.
Дайте характеристику хімічного елемента – Оксигену за типовим планом.
Завдання 3.
Дайте характеристику простої речовини – кисню за типовим планом (дайте відповідь на 1-3 пункти плану). Описуючи фізичні властивості кисню, вкажіть його агрегатний стан, колір, запах, смак, розчинність у воді, густину (порівняно з густиною повітря), температуру кипіння, температуру плавлення.
Завдання 4.
Кисень, випущений з балона, накопичується в нижній частині виробничого приміщення, заповнюючи всі приямки та траншеї і надовго там затримується. Поясніть причину цього явища.
Завдання 5.
Про фізичне чи хімічне явище, пов'язане з властивостями, добуванням і застосуванням кисню, йде мова:
а) кисень замерзає при температурі -218ºС;
б) срібні вироби на повітрі темніють унаслідок взаємодії з киснем;
в) більшість органічних речовин горить унаслідок реакції з киснем;
г) охолоджуючи повітря до низьких температур, його розділяють на кисень і азот.
Завдання 6.
У якій з речовин: алюміній оксиді чи силіцій оксиді більша масова частка Оксигену?
Домашня робота.
1. Які ознаки (властивості) є характерними для кисню?
а) добре розчиняється у воді;
б) погано розчиняється у воді;
в) легкий газ;
г) важчий за повітря;
д) не має смаку і запаху;
е) горить;
є) підтримує горіння.
2. У вигляді простої речовини кисень міститься в:
а) земній корі;
б) атмосфері;
в) дистильованій воді;
г) граніті.
3. У трьох посудинах без етикеток містяться повітря, кисень, вуглекислий газ. Як визначити вміст кожної посудини?
4. Поясніть, чому найпоширеніший елемент нашої планети – кисень був відкритий лише наприкінці ХVІІІ ст. *Підготуйте повідомлення про історію відкриття кисню.
Тема 23. Фізіологічна дія кисню. Добування кисню в лабораторії. Поняття про каталізатор
![]() Добування кисню:
Добування кисню:
1. Розкладання води (електричний струм, або t > 3000 Сº)
2Н2О = 2Н2 + О2
2. Розкладання меркурій (ІІ) оксиду (вперше добув Дж.Прістлі)
2НgО = 2Нg + О2
3. Розкладання калій перманганату (основний спосіб добування кисню в лабораторії)
2КMnО4 = К2МnО4 + МnО2 + О2
4. Розкладання гідроген пероксиду (перекису водню) (tº або каталізатор)
2Н2О2 = 2Н2О + О2
5. Розкладання бертолетової солі КClО3 (один з компонентів сірників)
2КClО3 = 2КСl + 3О2
Завдання 1.
«Dum spiro spero» – «поки дихаю – сподіваюсь», говорили античні мудреці. А українські козаки клялися захищати вітчизну до останнього подиху. Чому дихання розглядається як синонімом життя? Яку роль відіграє кисень у життєдіяльності організмів?
Завдання 2.
Ще Джозеф Прістлі помітив, що дихання чистим киснем – легке і приємне, і навіть висловив припущення, що колись це стане модним предметом розкошів. Чи дійсно це так? Коли і з якою метою використовується дихання людини чистим киснем?
Завдання 3.
У оповіданні письменника-фантаста Жуль Верна «Дослід доктора Окса» описується експеримент, який дозволив значно пришвидшити ріст та розвиток рослинних організмів: «Варто було кинути в землю насінину і вона миттю проростала. Пагін ріс не по дням, а по годинам... капуста росла як дерево, а гриби ставали розміром з парасольку. Але всі ці рослини швидко гинули: виснажені, спалені, безсилі». Як ви гадаєте, про який дослід йде мова в цьому оповіданні? Чим можна пояснити швидкий ріст та розвиток рослин? Чому вони швидко гинули? Поміркуйте, чи можна було б провести подібний дослід насправді? Сплануйте хід його проведення.
Завдання 4.
Питна вода «Куяльник – Тонус-кислород» газується не вуглекислим газом, як усі інші газовані води, а киснем. Виробники цієї води стверджують, що її «регулярне вживання покращує працездатність та знімає втому». Поясніть, на чому ґрунтується це твердження. Як практично довести, що до складу цієї води дійсно входить кисень, а не вуглекислий газ?
Досліди з перекисом водню.
Як антисептичний та кровоспинний засіб у медицині використовується перекис водню (гідроген пероксид) Н2О2. Антисептична дія перекису водню пов’язана з сильними окисними властивостями, які має кисень в момент виділення2Н2О2 = 2Н2О + О2. Дослідимо умови, за яких відбувається розкладання перекису водню:
Дослід 1.
Налийте невелику кількість розчину перекису водню в пробірку або прозору склянку. Спостерігайте повільне виділення кисню. Підрахуйте кількість бульбашок газу, що виділилася за певний проміжок часу (1 хв). Зробіть висновок про швидкість розкладання перекису водню за звичайних умов.
Дослід 2.
З'ясуйте дію сонячного світла на швидкість розкладання перекису водню. Прозору склянку з розчином перекису водню на 1-2 хв помістіть на пряме сонячне світло. Підрахуйте кількість бульбашок газу, що виділилася за 1 хв. Зробіть висновок про вплив сонячного світла на швидкість розкладання перекису водню.
Дослід 3.
Визначте вплив нагрівання на швидкість розкладання перекису водню. Склянку з розчином перекису водню нагрійте в долоні. Підрахуйте кількість бульбашок газу, що виділилася за 1 хв. Зробіть висновок про вплив помірного нагрівання на швидкість розкладання перекису водню.
Дослід 4.
Для розкладання перекису водню під впливом високої температури склянку з розчином перекису водню помістіть в посудину з гарячою водою. Спостерігайте інтенсивне виділення газу. Доведіть, що газ, який виділяється – кисень.
Дослід 5.
Каталізатором, що прискорює розкладання перекису водню є манган (ІV) оксид МnО2. Ця речовина входить до складу гальванічних елементів (батарейок), утворюється з калій перманганату при його прожарюванні: 2КMnО4 = К2МnО4 + МnО2 + О2 та при зберіганні розчину: 4КMnО4 + 2Н2О = 4МnО2↓ + 4КОН + 3О2↑. Додайте до розчину перекису водню невелику кількість манган (ІV) оксиду та спостерігайте інтенсивне розкладання перекису водню під дією неорганічного каталізатора.
Дослід 6.
Органічним каталізатором, що прискорює розкладання перекису водню є фермент каталаза, яка входить до складу клітинного соку рослинних та тваринних організмів. Розділіть розчин перекису водню на дві частини, в одну додайте невеликий шматочок м'яса, в іншу – подрібнений листок рослини. Спостерігайте інтенсивне виділення кисню.
Завдання 5.
У медичних довідниках зазначається, що перекис водню необхідно зберігати в прохолодному темному місці, в нещільно закритій пляшечці. Поясніть ці вимоги.
Завдання 6.
Оксана вважає, що рану та шкіру навколо неї слід обробляти рожевим розчином марганцівки, а Марійка переконана, що з цією метою краще використати перекис водню. Хто з них має рацію? Відповідь поясніть.
Тема 24. Хімічні властивості кисню
![]() Хімічні властивості кисню:
Хімічні властивості кисню:
1. Кисень реагує з усіма простими речовинами за виключенням Аu, Рt, F2, Сl2, Вr2, І2, інертних газів (реакція сполучення)
С + О2 = СО2
4Р + 5О2 = 2Р2О5
2. Кисень реагує з деякими складними речовинами
СН4 + 2О2 = СО2 + 2Н2О
3. Перетворення кисню на озон (гроза, УФ-промені)
3О2 ↔ 2О3
Завдання 1.
З перелічених формул випишіть формули оксидів, назвіть їх:
О2, Н2О, Сu2О, НСl, І2О5, FеО, NО, Ті2О3, МnО2, NаОН,Сl2О7, Р2О5.
Завдання 2.
Запишіть формули: а) плюмбум (ІV) оксиду, б) хром (ІІІ) оксиду, в) хлор (І) оксиду, г) нітроген (ІV) оксиду.
Завдання 3.
Розпізнайте, які хімічні реакції були проведені в кабінеті хімії, запишіть відповідні рівняння реакцій:
- пластична речовина червоного кольору горіла сліпучим полум’ям, при цьому спостерігалося виділення густого білого диму;
- жовта порошкоподібна речовина горіла синьо-фіолетовим полум’ям, з утворенням газу з різким запахом.
Завдання 4.
Фосфор використовують в димових шашках, а під час першої світової війни батареї противника обстрілювали снарядами, начиненими фосфором. З якою властивістю червоного фосфору це пов'язане? Напишіть відповідне рівняння реакції.
Завдання 5.
Напишіть рівняння хімічних реакцій між киснем і: магнієм Мg, цинком Zn, кремнієм Sі, вольфрамом W, миш’яком Аs, знаючи, що утворяться сполуки, формули яких: MgO, ZnO, SiO2, WO3, As2O3.
Завдання 6.
Як здійснити такі хімічні перетворення:
Н2О → О2 → Аl2О3 ?
Домашня робота.
1. Закінчить рівняння реакцій:
а) С + О2 → ; б) S + О2 → ; в) Р + О2 →
До якого типу належать ці реакції?
2. Напишіть рівняння хімічних реакцій між киснем і: залізом, міддю, калієм, барієм, знаючи, що утворяться сполуки, формули яких: Fe3O4, CuO, K2O, BaO.
3. Допишіть схеми реакцій і складіть хімічні рівняння:
а) В + … → В2О3
б) N2 + … → NО
в) … + О2 → СО
г) … + … → Н2О
4. Напишіть формулу сполуки Карбону з Гідрогеном, відносна молекулярна маса якої дорівнює відносній атомній масі кисню та рівняння реакції горіння цієї сполуки.
Дослід 1. (Досліди проводяться тільки в присутності дорослих!)
Проведіть реакцію кисню з міддю. Для цього нагрійте на повітрі за допомогою полум’я газової плити, або іншого нагрівного приладу мідну дротину або пластинку з попередньо очищеною до блиску поверхнею. Які ознаки свідчать про перебіг хімічної реакції між міддю та киснем? Складіть рівняння реакції міді з киснем.
Дослід 2.
Горіння цукру за звичайних умов не відбувається. Перевірте це, спробувавши запалити шматочок цукру-рафінаду в полум’ї газової плити або спиртівки. Опишіть свої спостереження. Насипте на шматочок цукру попіл від сигарети і знову помістіть його в полум’я. Тепер цукор добре горить. У тютюновому попелі є сполуки Літію, які виступають у ролі каталізатора горіння цукру. Таким чином, каталізатори не просто прискорюють хімічні реакції, а й роблять можливими проведення тих процесів, які за інших умов просто не відбуваються. Опишіть хід досліду.
Дослід 3.
Історичний дослід з вивчення складу повітря у 1775 році провів французький вчений, Антуан Лоран Лавуазьє, довівши, що повітря – не проста речовина, як це вважалося раніше, а суміш речовин. Дослід Лавуазьє продовжувався 12 діб і здійснювався з використанням металічної ртуті. Ми дещо спростимо його. На дні посудини з невисокими стінками зафіксуйте свічку. Налийте в посудину води. Запаліть свічку й накрийте її скляною банкою, щоб краї банки торкалися води. Що ви помітили? На яку висоту піднялася вода? Який висновок про склад повітря можна зробити?
Тема 25. Практична робота 3. Добування кисню та вивчення його властивостей
Завдання:
- вміти використовувати прилад для добування кисню;
- вміти визначати наявність кисню дослідним шляхом;
Мета: добути кисень розкладанням калій перманганату, зібрати його способами витіснення повітря та витіснення води, довести наявність кисню, дослідити його фізичні та хімічні властивості.
Обладнання: калій перманганат, вуглинка, скіпка, сірники, спиртівка, шпатель, пробірка, вата, пробка з газовідвідною трубкою, пробіркотримач, хімічні стаканчики, кристалізатор з водою, скляна пластинка, вапняна вода.
Завдання 1.
Закінчіть речення.
- у лабораторії кисень найчастіше добувають розкладанням..., або …
- кисень збирають способом витіснення повітря тому що він...
- під час збирання кисню способом витіснення повітря, пробірку тримають...
- кисень збирають способом витіснення води тому що він...
- наявність кисню в посудині можна перевірити за допомогою...
- вугілля горить в кисні ...
Завдання 2. Зберіть прилад для добування кисню.
- замалюйте зібраний прилад, підпишіть його деталі;
- для чого кладуть пухкий жмут вати біля отвору пробірки з калій перманганатом?
- як перевірити прилад на герметичність?
Завдання 3. Отримайте кисень способом розкладання калій перманганату. Зберіть його способом витіснення повітря.
Перевірте наявність кисню в посудині за допомогою тліючої скіпки.
- запишіть рівняння реакції розкладання калій перманганату, вкажіть її тип;
- як перевірити, чи заповнена посудина киснем?
- опишіть фізичні властивості кисню.
Завдання 4. Продовжуйте нагрівання перманганату і зберіть кисень способом витіснення води.
Коли витісниться вода спочатку вийміть газовідвідну трубку з кристалізатора, а потім припиніть нагрівання.
Закрийте посудину з киснем під водою скляною пластинкою і швидко вийміть її з кристалізатора з водою.
Внесіть в посудину розжарену вуглинку.
- чому потрібно спочатку вийняти газовідвідну трубку з кристалізатора, а потім припинити нагрівання, а не навпаки?
- що відбувається при внесенні розжареної вуглинки в посудину з киснем? Опишіть ознаки реакції, запишіть рівняння реакції, вкажіть його тип;
- порівняйте інтенсивність горіння речовин у кисні та в повітрі, поясніть причини відмінності.
Завдання 5. Налийте в посудину, у якій горіла вуглинка, вапняної води та збовтайте її.
- що спостерігаєте?
- чому помутніла вапняна вода? Про що це свідчить?
- для визначення якої речовини може використовуватися вапняна вода?
Завдання 6. Зробіть висновок, у ньому вкажіть:
- способи добування кисню в лабораторії;
- способи збирання кисню;
- фізичні та хімічні властивості кисню.
Чому ви навчилися на практичній роботі?
Домашня робота.
1. Опишіть процеси в природі та в побуті, які відбуваються за участю кисню. По можливості запишіть відповідь рівняннями реакцій.
2. Закінчить рівняння реакцій:
а) Са + О2 → ; б) Sі + О2 → ; в) К + О2 →
До якого типу належать ці реакції?
3. Напишіть рівняння хімічних реакцій між киснем і: алюмінієм, магнієм, літієм, ртуттю, знаючи, що утворяться сполуки, формули яких: Al2O3, MgO, Li2O, HgO.
4. Як експериментально довести той факт, що під час добування кисню з гідроген пероксиду каталізатор манган (ІУ) оксид не втратився і залишився без змін?
Тема 26. Поняття про окиснення, горіння. Умови виникнення та припинення горіння
![]() Горіння відбувається швидко, супроводжується виділенням світла та тепла.
Горіння відбувається швидко, супроводжується виділенням світла та тепла.
Окиснення відбувається повільно, супроводжується виділенням тепла.
Умови виникнення горіння:
1. Нагрівання речовини до температури займання.
2. Доступ кисню (повітря).
Умови припинення горіння:
1. Охолодження речовини нижче від температури займання.
2. Припинення доступу кисню (повітря).
Завдання 1.
Випишіть з запропонованого списку формули оксидів.
а) НСl, КОН, СаО, ZnО;
б) NаОН, Н2СО3, К2О, Fе2О3;
в) SО2, НІ, СО2, СН4.
Завдання 2.
Напишіть формули оксидів.
а) К, Са, Fе(ІІІ), С(ІV);
б) Nа, Zn, Аl, С(VІ);
в) Н, Сu, Р(V), Сr(VІІ).
Завдання 3.
Назвіть оксиди.
а) Сu2О, СuО, Fе2О3, Nа2О;
б) МnО, Мn2О7, Мn2О3, Аg2О;
в) SО2, SО3, СаО, К2О.
Завдання 4.
Складіть рівняння горіння або повільного окислення речовин, назвіть продукти реакції:
а) Nа, Мg, Fе(ІІІ), СН4;
б) К, Са, Аl, SіН4;
в) Н2, С, С(ІV), Н2S.
Завдання 5.
Напишіть рівняння хімічних реакцій простих речовин з киснем, якщо в результаті реакцій утворилися плюмбум (ІV) оксид, хром (ІІІ) оксид, осмій (VІІІ) оксид, фосфор (V) оксид.
Завдання 6.
В організмі людини відбуваються процеси повільного окиснення органічних речовин. Визначте умови, ознаки, вихідні речовини та продукти реакції. Яке значення цих процесів для життєдіяльності організму людини?
Завдання 7.
Смітні кури будують гніздо з гниючих залишків рослин. У нього вони відкладають яйця, загортаючи їх все тими ж залишками рослин. Щодоби самець за допомогою дзьоба визначає температуру в гнізді, частково розгортає купу, або, навпаки, робить її вищою. Який процес відбувається з рештками рослин? Поясніть поведінку самця.
Завдання 8.
Вологе зерно не можна зберігати у великих купах: може відбутися його обвуглювання і навіть самозаймання. Поясніть, чому це відбувається. Щоб зберегти зерно, його перелопачують, тобто перекидають з місця на місце. Поясніть, чому це необхідно робити.
Домашня робота.
1. Які способи гасіння полум’я слід використовувати в наступних випадках:
а) на людині загорівся одяг;
б) пожежу спричинило коротке замикання, причому електричний струм ще не відключений;
в) загорівся легковий автомобіль;
г) горить розлитий бензин.
2. Виходячи з умов виникнення та припинення горіння поясніть, чому дмухаючи на сірник його гасять, а дмухаючи на полум’я – роздувають, щоб воно краще горіло.
3. Чому небезпечно залишати в гаражі промаслене ганчір’я, яке використовувалося для протирання автомобіля?
4. Першу хімічну реакцію провела доісторична людина, яка навчилася добувати вогонь. З тих пір і до наших днів реакції горіння відіграють визначальну роль у нашому житті. Вони приносять у дім тепло, рухають автомобілі й літаки, допомагають здійснювати виробничі процеси. Розкрийте роль процесів горіння та повільного окиснення в житті людини, визначте їх позитивне та негативне значення.
Дослід 1 (досліди проводьте тільки у присутності дорослих!).
Переконайтеся, що для того, щоб речовина загорілася, її не обов’язково підпалювати. Для цього в невеликий металевий ковпачок (можна використати наперсток) помістіть трохи подрібненого воску або стеарину. Нагрівайте ковпачок у верхній частині полум’я таким чином, щоб речовина, яка знаходиться в ковпачку не стикалася з вогнем. Через деякий час речовина спалахне. Загасити її можна двома способами. По-перше, можна охолодити речовину нижче температури займання. Для цього нижню частину ковпачка опустіть в холодну воду (вода не повинна потрапити всередину ковпачка). Температура палаючої речовини знизиться й вона погасне. По-друге, можна припинити доступ кисню. Для цього ковпачок разом з палаючою в ньому речовиною накрийте невеликою склянкою. Як тільки кисень, який містився під склянкою вигорить, речовина погасне. Опишіть хід досліду. Поясніть практичне значення знання умов припинення горіння.
Дослід 2.
Силікатний клей іще називають рідким склом. Розбавте клей водою наполовину, просочіть ним шматочок тканини а потім висушіть її. Спробуйте запалити цю тканину. Просочений матеріал не загорається. Тонка плівка висохлого скла перекриває доступ повітря, що перешкоджає горінню. Рідким склом просочують театральні завіси, спецодяг працівників гарячих цехів.
Дослід 3.
Якщо на тліючу деревину висипати дрібку калій перманганату (марганцівки), то там, куди потрапили кристали перманганату, спалахне вогонь. Калій перманганат при нагріванні розкладається з виділенням кисню, а в атмосфері кисню тліюча деревина загорається. Пам’ятайте, що калій перманганат – сильний окисник, тому брати його руками не можна.
Дослід 4.
Ви можете виготовити фейєрверк у домашніх умовах. Для цього вам знадобляться калій перманганат (марганцівка), деревне вугілля та порошок заліза. Калій перманганат і деревне вугілля слід розтерти в дрібний порошок, окремо одне від одного та додати до них порошок заліза. Усі порошки старанно перемішують їх, висипають у металевий ковпачок (можна використати наперсток) і на дротяному кільці вносять у полум’я. Коли маса розжариться, з ковпачка вилітатиме красивий дощ іскор.
Тема 27. Колообіг Оксигену в природі. Застосування кисню
Завдання 1.
Учені підрахували, що весь кисень нашої планети повністю оновлюється за 2000 років. Розподіліть нижченаведені процеси на ті, з якими пов'язане використання кисню та ті, з якими пов'язане надходження кисню в атмосферу. По можливості розширте цей список. Підкресліть ті процеси, інтенсивність яких, на вашу думку, істотно змінилася за останні сто років та позначте знаками > або < напрямок зміни інтенсивності перебігу даних процесів. Зробіть висновок про те, яким чином змінюється кругообіг кисню в наш час та до яких наслідків це може привести.
Дихання живих організмів; гниття органічних решток; фотосинтез; спалювання палива; спалювання пального в двигунах внутрішнього згорання.
Завдання 2.
Опишіть процес колообігу Оксигену в природі, використавши для цього наступні вирази: зелені рослини, фотосинтез, атмосфера, дихання, спалювання палива, гниття органічних решток.
Завдання 3.
Яка роль зелених рослин у колообігу Оксигену в природі, підтриманні чистоти атмосфери? До яких наслідків може привести інтенсивне вирубування лісів, яке відбувається в наш час?
Завдання 4.
Андрійко й Оксанка мають домашні акваріуми і намагаються створити для їх мешканців оптимальні умови існування. Проте іноді їхні погляди розходяться. Поясніть, як вплинуть на життєдіяльність мешканців акваріуму наступні фактори:
а) заміна живих акваріумних рослин на штучні пластмасові;
б) заселення акваріума лише рослинами;
в) заселення акваріума лише рибками та молюсками;
Домашня робота.
1. Яке застосування кисню пов’язане з його здатністю: а) підтримувати горіння; б) підтримувати дихання. Відповідь оформіть у вигляді таблиці.
|
Хімічні властивості кисню |
Галузь застосування |
|
|
|
2. Пригадайте умови підтримання горіння, і поясніть, чому зварювати та різати ацетиленово-кисневим пальником можна і під водою?
3. Напишіть рівняння реакції горіння ацетилену. Формула ацетилену С2Н2.
4. Складіть рівняння реакцій, за допомогою яких можна здійснити перетворення:
НgО → О2 → Н2О → О2 → Fе3О4
Дослід 1.
У склянку з водою помістіть кілька паростків елодеї або іншої водяної рослини. Зверху парости накрийте лійкою на яку одягніть пробірку з водою. Поставте зібраний прилад на освітлене місце. Коли пробірка заповниться газом закрийте її, переверніть, відкрийте пробку та внесіть у пробірку тліючу скіпку. Що спостерігаєте? Поясніть результати досліду. Опишіть дослід, зобразіть схему приладу, використаного в досліді. Зробіть висновки.
Дослід 2.
Підрахуйте кількість бульбашок кисню, які відриваються від поверхні водної рослини за одиницю часу. Дослідіть вплив на інтенсивність фотосинтезу рослин температури середовища (температуру води регулюйте, доливаючи у посудину з рослиною охолоджену чи підігріту воду), дослідження проведіть при температурах від +10 ºС до +50 ºС з інтервалом температур у 10ºС. Визначте, за якої температури фотосинтез відбувається найбільш інтенсивно.
тема 28. Ферум. Залізо. Фізичні властивості заліза. Поширення та застосування заліза
Завдання:
- вміти характеризувати фізичні властивості заліза;
- вміти описувати поширеність Феруму в природі;
- обґрунтувати застосування заліза
Завдання 1.
Користуючись періодичною системою хімічних елементів, визначте положення в ній Феруму: порядковий номер, період, групу.
Завдання 2.
Дайте характеристику хімічного елемента – Феруму за планом:
1. Хімічний символ.
2. Відносна атомна маса.
3. Валентність.
4. Поширення елемента в природі.
Завдання 3.
Опишіть фізичні властивості заліза за планом:
- Агрегатний стан.
- Колір.
- Металічний блиск.
- Розчинність у воді.
- Густина.
- Пластичність.
- Теплопровідність.
- Магнітні властивості.
- Температура кипіння.
10. Температура плавлення.
Завдання 4.
Лабораторний дослід. Вивчення фізичних властивостей заліза.
Обладнання: порошок заліза, залізні ошурки, залізна пластинка, магніт, стакан з водою, пісок, вироби з заліза, наприклад, сталеві скріпки, залізна та пластмасова ложечки.
1. Розгляньте зразки залізного порошку, залізні ошурки та залізну пластину. Який колір вони мають?
2. Опустіть сталеві скріпки у склянку з водою. Потонули вони, чи ні? Зробіть висновок про густину заліза та його сплавів.
3. У склянку з гарячою водою опустіть дві ложечки: залізну та пластмасову. Яка з них швидше передала тепло? Зробіть висновок про теплопровідність заліза.
4. Спробуйте розігнути сталеву скріпку. Зігніть її знову. Зробіть висновок про пластичність заліза.
5. Перевірте дію на залізо та його сплави магніту. Чи притягує магніт залізні вироби через шар тонкого паперу? Зробіть висновок про магнітні властивості заліза.
6. Змішайте порошок заліза з піском, накрийте суміш аркушем тонкого паперу та піднесіть до неї магніт. Обережно підніміть магніт разом з аркушем паперу. Що спостерігаєте? Чи зберігає залізо свої фізичні властивості, перебуваючи в суміші з піском?
Завдання 5.
Наведіть формули та назви природних сполук Феруму, які використовуються як руди при виплавці заліза.
Які великі родовища залізних руд є на Україні?
Завдання 6.
Як застосування заліза пов'язане з його фізичними властивостями? Відповідь оформіть у вигляді таблиці:
|
Фізичні властивості заліза |
Галузь застосування |
|
|
|
Домашня робота.
1. Наведіть приклади виробів, що застосовуються в побуті і виготовлені з сплавів заліза – чавуну і сталі. З якими властивостями заліза та його сплавів пов'язане застосування цих виробів?
 2. Сталеві деталі навіть дуже великої ваги на підприємствах часто переносять за допомогою потужних магнітів. Це дуже зручно: не потрібно закріплювати деталі, приварювати до них скоби для транспортування тощо. Проте розжарені залізні заготовки ніколи не транспортують за допомогою магніту. Чому?
2. Сталеві деталі навіть дуже великої ваги на підприємствах часто переносять за допомогою потужних магнітів. Це дуже зручно: не потрібно закріплювати деталі, приварювати до них скоби для транспортування тощо. Проте розжарені залізні заготовки ніколи не транспортують за допомогою магніту. Чому?
3. Накресліть у зошиті схему, яка
відображає поширеність хімічних елементів на Землі, вставте в неї символи хімічних елементів.
Вкажіть місце, яке займає Ферум за поширеністю:
а) серед усіх хімічних елементів;
б) серед металів.
4. Пліній пише, що залізні рудокопи є найбільшими благодійниками людства, бо з отриманого ними заліза виготовляють міцні знаряддя праці, які значно полегшують працю, і, у той же час, найстрашнішими ворогами людяності, бо залізо використовують для виготовлення гострої зброї, яка робить війни більш кровопролитними. Як ви вважаєте, те, що одна й та ж речовина може використовуватися у різний спосіб, пов'язане в першу чергу з властивостями цієї речовини, чи з намірами людини, яка її використовує? Наведіть інші приклади з історії, коли певні відкриття, винаходи, явища використовувалися у діаметрально протилежних цілях, або, коли те, що мало принести людям користь, приносило шкоду. Як цьому запобігти?
Дослід.
Проведіть домашній експеримент для з'ясування впливу середовища на процеси руйнування (іржавіння) заліза. Для цього шість однакових залізних цвяхів, зачищених наждачним папером, помістіть у різні середовища:
- перший – у склянку з повітрям;
- другий – у склянку з кип’яченою водою (кип’ятіння видаляє розчинений у воді кисень), першу та другу склянку закрийте кришками;
- третій – у склянку з некип’яченою водою, яка містить розчинений кисень;
- четвертий у склянку з водою, у якій розчинена чайна ложка солі;
- п’ятий – у склянку з водою, у якій розчинена чайна ложка соди;
- шостий цвях змастіть вазеліном або олією і помістіть у склянку з водою.
Зробіть висновок про швидкість руйнування заліза в різних умовах, чинники, що прискорюють та сповільнюють цей процес.
Тема 29. Хімічні властивості заліза. Руйнування (іржавіння) заліза в природних умовах
![]()
Хімічні властивості заліза
1. Взаємодія з киснем (реакція сполучення)
3Fе + 2О2 = Fе3О4 (FеО·Fе2О3) – ферум (ІІ, ІІІ) оксид
2. Взаємодія з сіркою (реакція сполучення)
Fe + S = FeS – ферум сульфід
3. Корозія (іржавіння) заліза (реакція сполучення)
4 Fe + 6Н2О + 3О2 = 4Fe(ОН)3
Завдання 1.
Серед явищ, які відбуваються за участю заліза, визначте фізичні та хімічні, запишіть їх у дві колонки.
а) виплавка заліза з руди;
б) отримання сплавів заліза;
в) прокатування заліза в листи;
г) виготовлення із заліза різних деталей;
д) іржавіння заліза;
е) горіння заліза.
Завдання 2.
У природі залізо утворює два ряди сполук, у яких воно проявляє валентність ІІ та ІІІ. Сполуки двовалентного заліза утворюються за вологих прохолодних умов, їх розчини мають зеленкувате забарвлення. Сполуки тривалентного заліза утворюються в умовах сухого жаркого клімату, вони мають жовто-буре забарвлення. Поясніть, як за кольором глин, які відкладалися в різні геологічні епохи та періоди, можна визначити клімат цих епох, якщо відомо, що колір глин визначається здебільшого саме сполуками заліза.
Завдання 3.
Плівка синюватого кольору, яка іноді утворюється на поверхні боліт – це ферум (ІІІ) гідроксид Fe(ОН)3, який виникає, коли розчинені у воді сполуки двовалентного заліза взаємодіють з киснем повітря. Її часто плутають з плівкою від бензину, проте відрізнити їх досить легко: гідроксидна плівка має рвані краї і на ній не виникають кольорові дифракційні кільця. З часом ця плівка осідає на дно водойми, перетворюючись на болотну руду – бурий залізняк 2Fe2О3·3Н2О. З попереднього завдання пригадайте умови утворення природних сполук заліза та поясніть, чому родовища бурого залізняку як правило зустрічаються в помірній кліматичній зоні.
Завдання 4.
Опишіть реакції заліза з киснем, сіркою та водою, напишіть рівняння реакцій, для кожної з них зазначте вихідні речовини, продукти реакції, тип реакції, її ознаки та умови перебігу.
Завдання 5.
Якби атмосфера Землі складалася з чистого кисню, залізо б згорало
в ній, як горить воно в банці, заповненій киснем. На щастя, в атмосфері нашої планети кисень складає лише п’яту частину, тому горіння заліза і сталевих виробів у ній дуже сповільнюється. Сповільнюється, але не припиняється. Ця невидима пожежа, яку називають корозією, щороку знищує 15-20% усього заліза та сплавів на його основі. Причому, руйнується не просто метал, а вироби з нього, вартість яких незмірно перевищує вартість металу.
- наведіть приклади іржавіння заліза, які ви спостерігали особисто, або про які вам стало відомо з інших джерел;
- які негативні наслідки має іржавіння заліза, якої шкоди воно завдає або може завдати людині;
- про які способи захисту заліза від руйнування вам відомо? Завдання 6.
На фарбування знаменитої Ейфелевої вежі – символу Парижа – за більш ніж 200 років її існування було витрачено в 10 разів більше коштів, ніж на її спорудження. З якою метою фарбують «залізну мадам» (так французи називають Ейфелеву вежу)? Чи не можна було б якимось чином зекономити ці кошти?
Дослід 1.
Сполуки заліза є необхідними для життєдіяльності організмів, проте вміст заліза у воді, який перевищує 200 мг/л може бути токсичним. Згідно з санітарними нормами, наявність заліза в питній воді не повинна перевищувати 0,3 мг/л. Визначити, чи дотримується ця норма можна за допомогою звичайної чайної заварки. У прозору склянку налийте чайну заварку та долийте до неї біля 100 мл води, якість якої ви перевіряєте. Якщо суміш набула темно-сизого кольору, це означає, що допустимий вміст заліза в ній значно перевищений. Це часто буває з водопровідною водою, якщо залізні труби пошкоджені корозією. Вживати таку воду шкідливо для здоров'я.
Дослід 2.
Відомо, що якщо у прісній воді залізні вироби руйнуються приблизно за 10 років, то в морській воді процес корозії значно пришвидшується. З'ясуємо причини цього явища. Для досліду потрібні два залізних цвяха, попередньо зачищені наждачним папером. Один з них помістіть у склянку з прісною водою, а другий – у склянку з водою, в якій розчинили чайну ложку солі (кухонної, а ще краще морської). Через тиждень порівняйте швидкість руйнування заліза в прісній та солоній воді, зробіть висновок про вплив солі на швидкість руйнування заліза. Опишіть хід досліду.
Дослід 3.
Якщо одні речовини пришвидшують швидкість корозії заліза, то інші її сповільнюють. Переконайтеся в цьому на досліді. Два залізних цвяха, попередньо зачищені наждачним папером, помістіть у склянки з водою, причому в одній з склянок розчиніть чайну ложку питної соди. Через один-два тижні порівняйте швидкість руйнування заліза в чистій воді та у воді з розчиненою в ній содою, зробіть висновок про вплив соди на швидкість корозії заліза. Опишіть хід досліду.
Дослід 4.
Ви, напевно, чули про Делійську колону – предмет релігійного поклоніння багатьох індусів. У вологому та жаркому кліматі Індії залізо руйнується дуже швидко, тому відсутність слідів корозії на залізній колоні, встановленій у V ст. н.е., викликає здивування людей. Вчені пояснюють цей феномен високою чистотою заліза, з якого виготовлена колона. У той же час сам принцип створення нержавіючих сталей на основі заліза передбачає введення до складу сплаву інших металів, найчастіше хрому та нікелю. Щоб з'ясувати вплив контакту з іншим металом на швидкість корозії заліза, проведемо наступний дослід. Три цвяха, зачищених наждачним папером, помістимо у склянки з водою. Один цвях не контактуватиме з іншими металами, другий обмотайте мідним дротом, третій – алюмінієвим дротом. Через тиждень порівняйте швидкість руйнування заліза, зробіть висновок. Опишіть хід досліду.
Дослід 5.
Визначення факторів, що впливають на швидкість руйнування заліза має велике наукове та практичне значення. Сплануйте та проробіть експеримент з визначення впливу різних факторів зовнішнього середовища на швидкість корозії заліза. Опишіть хід досліду.
Тема 30. Узагальнення та систематизація знань з теми «Прості речовини»
Завдання:
- узагальнити та систематизувати матеріал вивченої теми
Початковий рівень.
1. Кисень збирають витісненням повітря, тримаючи пробірку:
а) вниз дном; б) догори дном.
2. У повітрі найбільший вміст:
а) кисню; б) азоту; в) вуглекислого газу.
3. На яких властивостях кисню: А) підтримувати горіння Б) забезпечувати дихання ґрунтується його застосування:
а) зварювання металів; б) кисневі подушки; в) кисневі маски; г) добавляють у повітря в доменних печах.
4. Закінчить рівняння реакції: S + О2 → …
5. Порядковий номер Феруму в періодичній системі хімічних елементів: а) 26; б) 36; в) 46; г) 56.
6. Складіть рівняння реакції за схемою: Fe + S → ...
Середній рівень
1. Про Оксиген чи про кисень йде мова у виразах:
а) погано розчиняється у воді;
б) необхідний для дихання;
в) входить до складу води;
г) має відносну молекулярну масу 32.
2. При горінні заліза у кисні утворюється:
а) газ без кольору;
б) тверда речовина сірого кольору;
в) тверда речовина бурого кольору.
3. Умовою підтримання горіння є:
а) доступ кисню;
б) нагрівання речовини вище температури займання;
в) припинення доступу повітря.
4. При горінні фосфору в кисні утворюється:
а) газ без кольору;
б) газ коричневого кольору;
в) тверда речовина білого кольору;
5. Наявність солі у морській воді процес іржавіння заліза:
а) пришвидшує;
б) уповільнює;
в) не змінює.
6. Закінчить рівняння реакцій:
а) Н2О →;
б) Н2О2 →;
Достатній рівень
1. Напишіть рівняння реакції горіння метану СН4.
2. Допишіть рівняння хімічних реакцій, розставте коефіцієнти.
Р + О2 →
С + О2 →
Zn + О2 →
Аl + О2 →
Fе + О2→
3. Кисень в лабораторії можна добути з таких речовин:
а) калій перманганату (КМnО4); б) меркурій (ІІ) оксиду (НgО).
Напишіть рівняння реакцій, та позначте речовину, користування якою є більш безпечним.
4. Обчисліть масові частки елементів
а) у фосфор (V) оксиді; б) у ферум (ІІ) сульфіді.
5. Напишіть рівняння реакцій за такими схемами:
а) Zn + … → ZnО
б) КМnО4 → … + … + О2
в) Fе + … → Fе3О4
г) … + … → FеS
д) Н2О2 → … + О2
е) Н2S + … → … + SО2
6. Складіть формули за валентністю та напишіть рівняння реакції:
а) Lі +О2→
б) Аl +О2→
в) Mg + О2→
г) Fе +S →
ж) Н2 + О2 →
Високий рівень
1. Допишіть рівняння реакцій, розставте коефіцієнти, назвіть продукти реакцій. До якого типу належать ці реакції?
КСlО3 →
Н2О2 →
Н2О →
NаNО3 →
2. Напишіть рівняння реакцій взаємодії кисню з простими речовинами кремнієм, вольфрамом, ванадієм, натрієм, воднем.
3. Здійсніть перетворення:
КNО3 → О2→ Р2О5
4. Обчисліть масову частку кристалізаційної води в залізному купоросі FеSO4·7Н2О.
5. Наведіть приклади утворення води в результаті реакцій:
а) розкладу; б) сполучення.
6. Виведіть формулу борної кислоти, яку широко використовують в медицині як антисептичний засіб, якщо відомо, що масова частка в ній Гідрогену – 5%, Бору – 18%, Оксигену – 77%.
-
Дякую за хороші матеріали .

про публікацію авторської розробки
Додати розробку