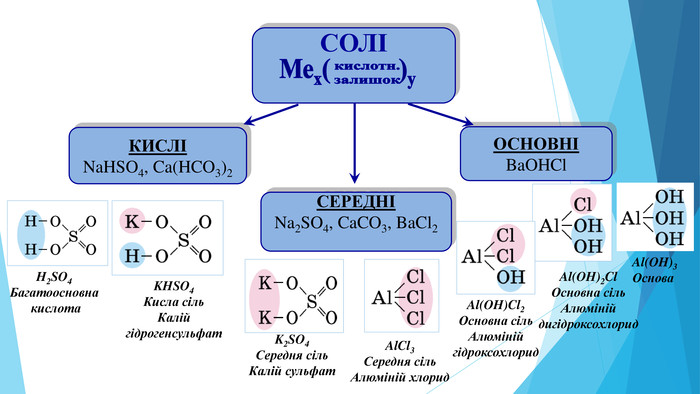
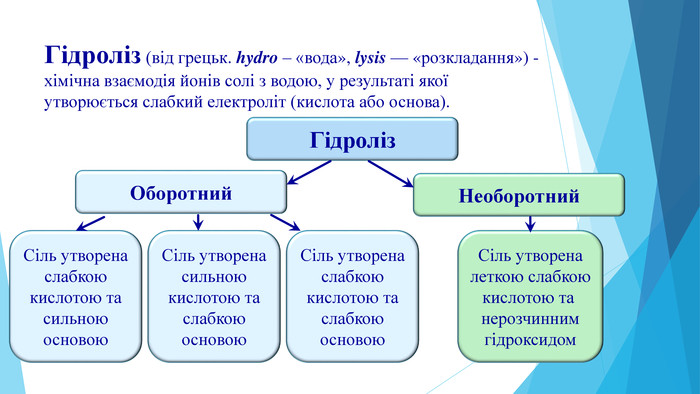
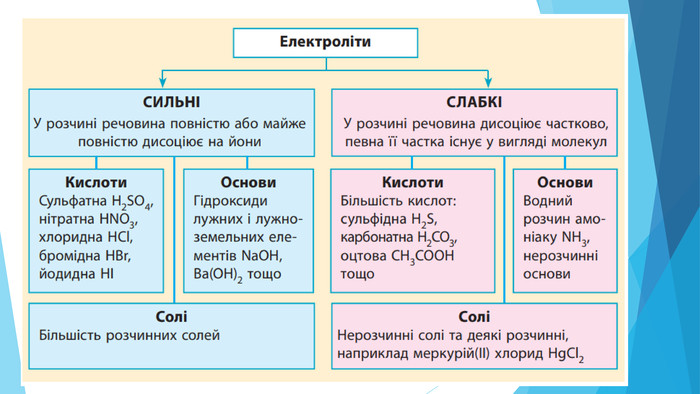
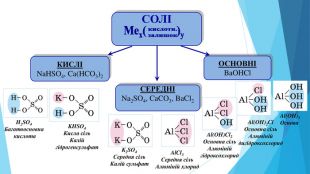
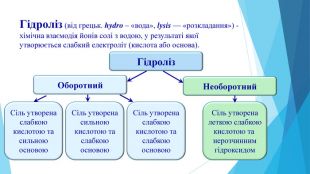
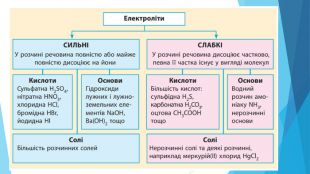
Презентація "Кислотність розчинів солей. Гідроліз солей"
Про матеріал
Презентація до уроку хімії в 11 класі "Кислотність розчинів солей. Гідроліз солей". Презентація містить посилання на відеодосліди. Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку