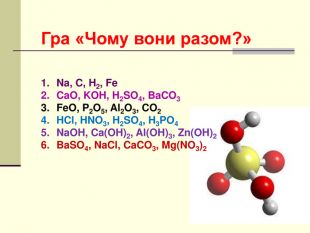
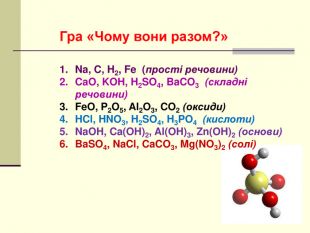
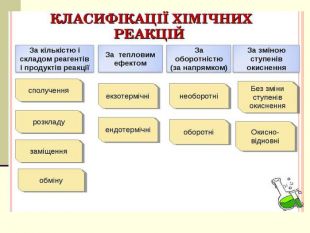
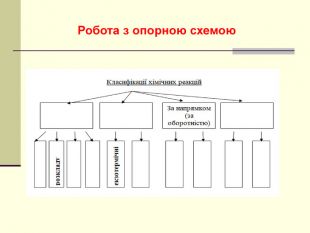
Презентація "Класифікація хімічних реакцій за кількістю і складом реагентів та продуктів реакції: реакції сполучення, розкладу, обміну, заміщення."
Про матеріал
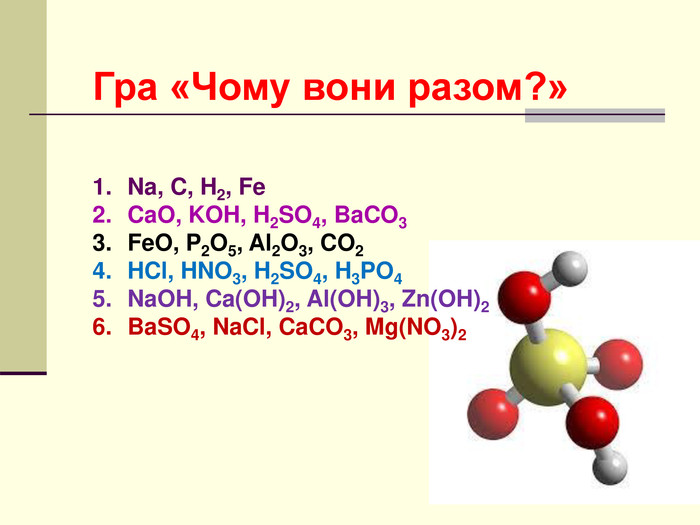
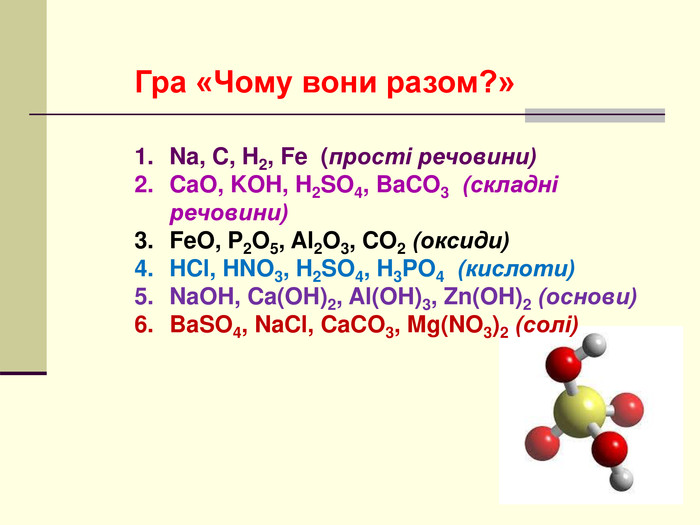
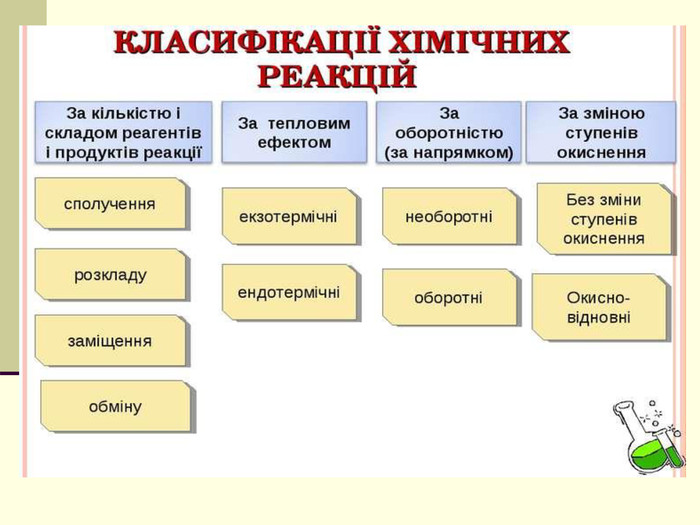
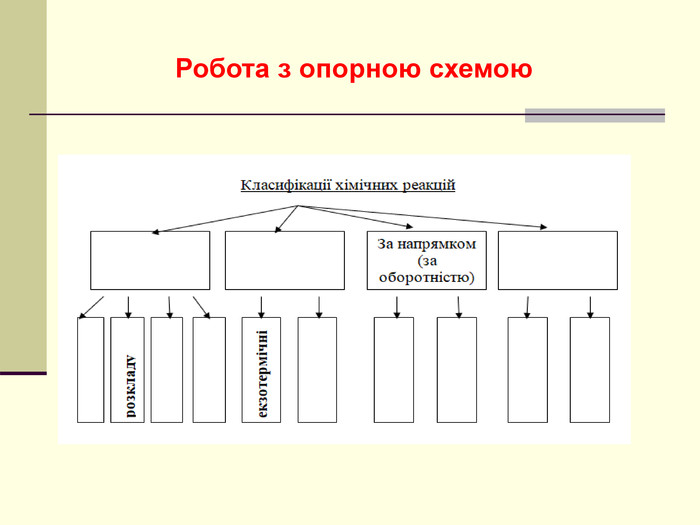
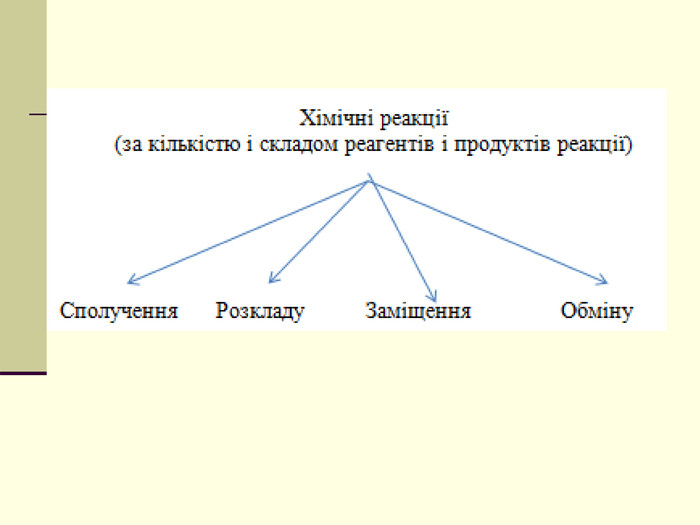
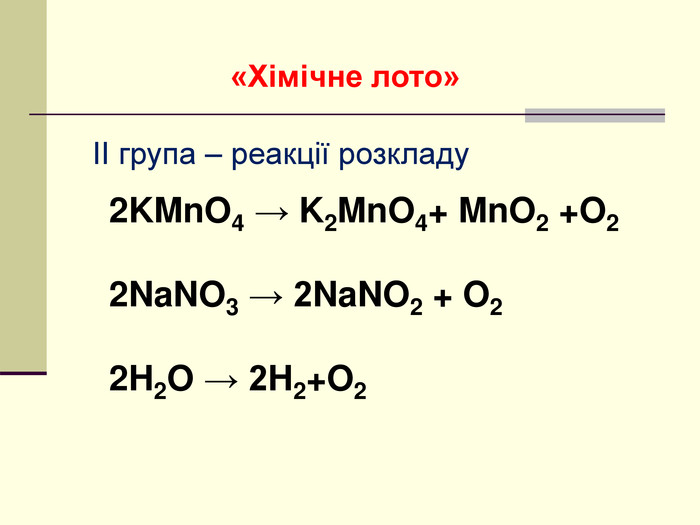
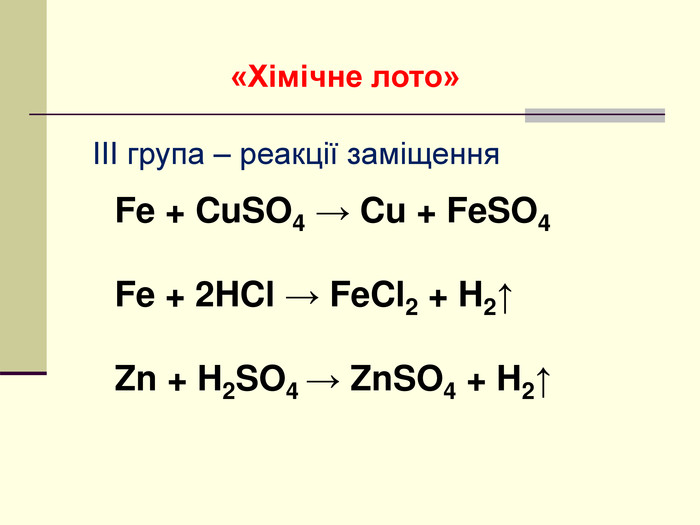
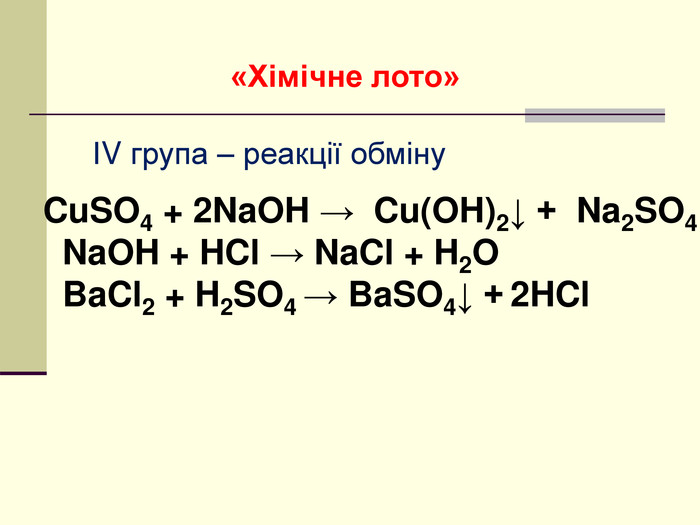
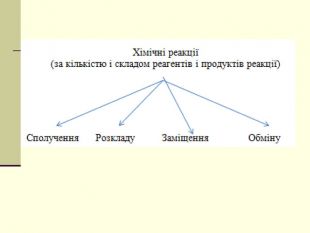
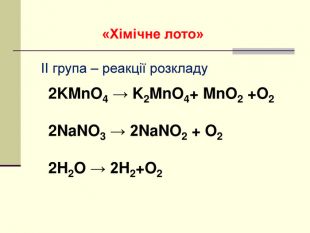
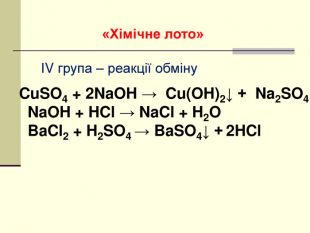
навчальна: поглибити знання учнів про класифікацію хімічних реакцій за різними ознаками, удосконалити навички складання рівнянь хімічних реакцій, узагальнити й систематизувати знання учнів про типи хімічних реакцій за складом вихідних та кінцевих речовин, формувати навички розпізнавання типів реакцій теоретично - за рівняннями реакції, експериментально - за ознаками хімічних реакцій;
розвивальна: розвивати навички і вміння складати рівняння хімічних реакцій, розвивати логічне мислення учнів, навички самостійної пізнавальної діяльності;
виховна: сприяти формуванню наукового світогляду учнів; виховувати вміння роботи в колективі, формувати здоров'язберігаючу компетентність.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
ppt
До підручника
Хімія 9 клас (Григорович О.В.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку