Презентація: "Класифікація хімічних реакцій за кількістю та складом реагентів і продуктів реакцій"
Про матеріал
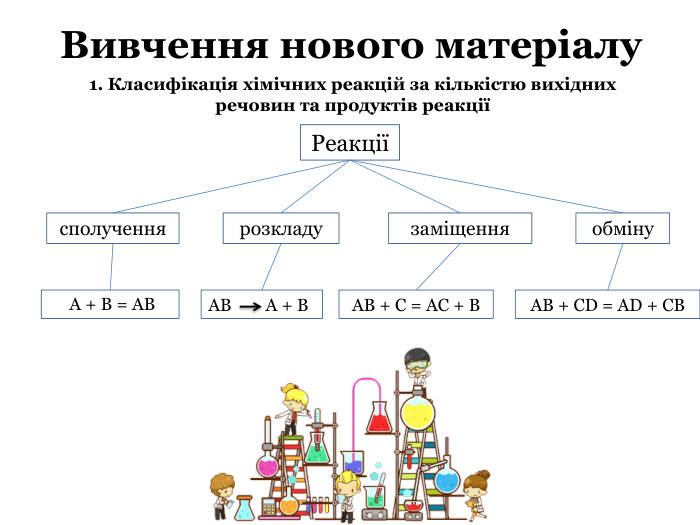
Презентація на тему "Класифікація хімічних реакцій за кількістю та складом реагентів і продуктів реакцій" містить тестові матеріали, фото, посилання на відео експерименту, підкріплена відповідними рівняннями реакцій. Може використовуватися як доповнення до уроку в класі, а також в якості наочного матеріалу для дистанційних занять. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку