Презентація "Класифікація хімічних реакцій за різними ознаками". Хімія. 9 клас (до конкурсу "Учитель року - 2015")
Про матеріал
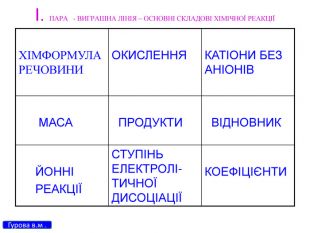
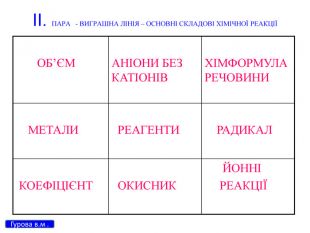
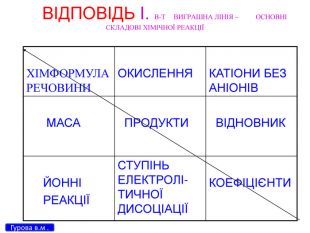
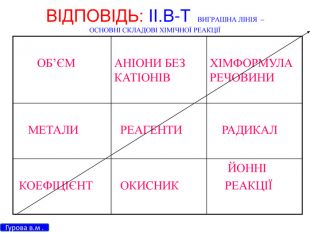
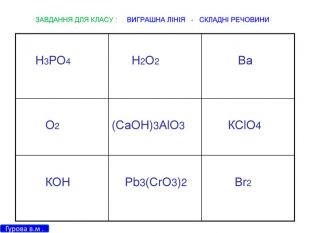
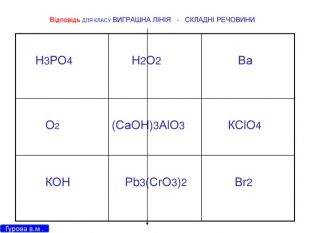
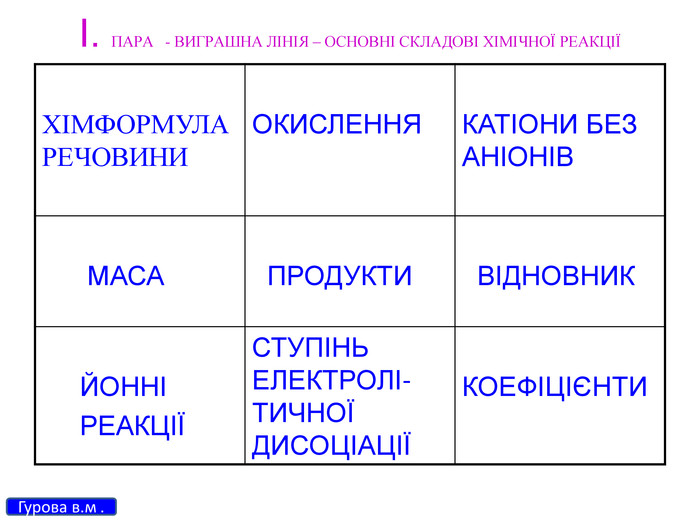
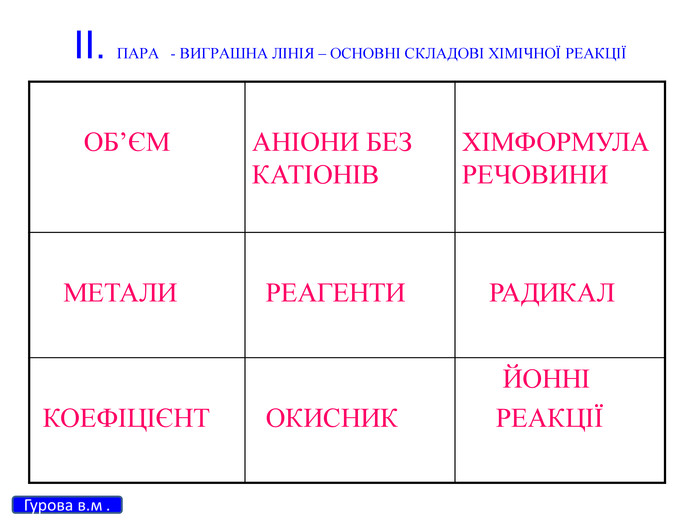
Презентація для 9 класу на тему: "Класифікація хімічних реакцій за різними реакціями". Різні цікаві тести, запитання, завдання та хімічні реакції, що перерірять кмітливість, спритність дітлахів у вмінні розв'язувати завдання на уроці хімії. І все це, ти знайдеш у цій презентації...
Перегляд файлу



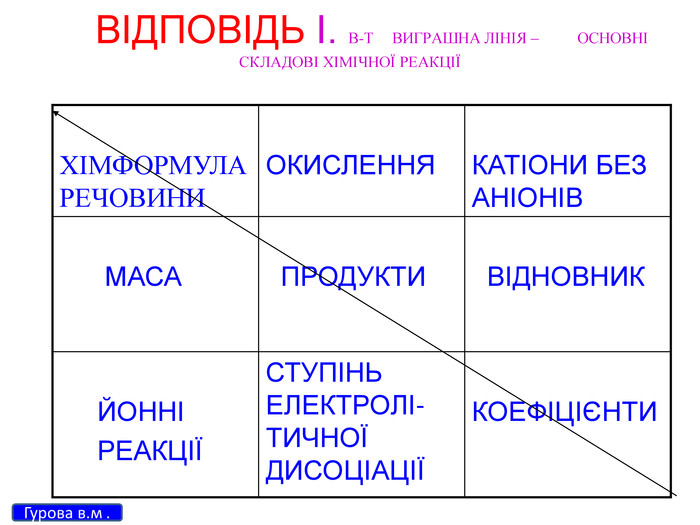
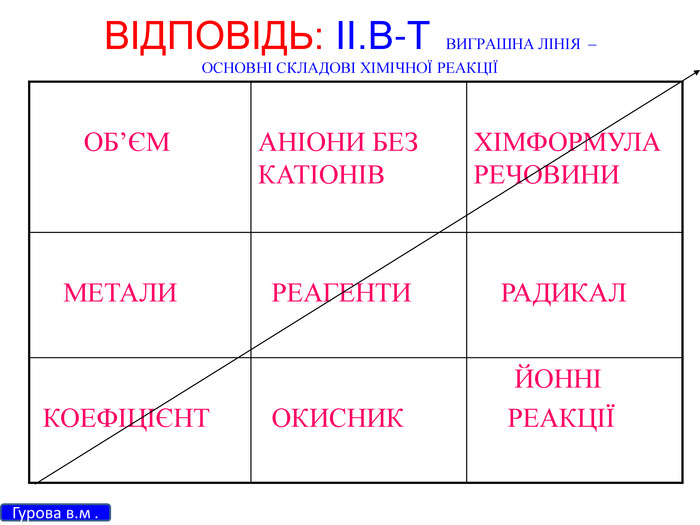


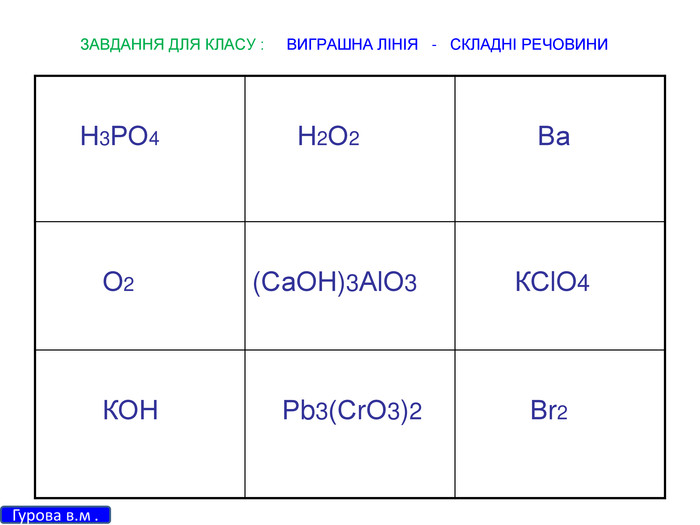
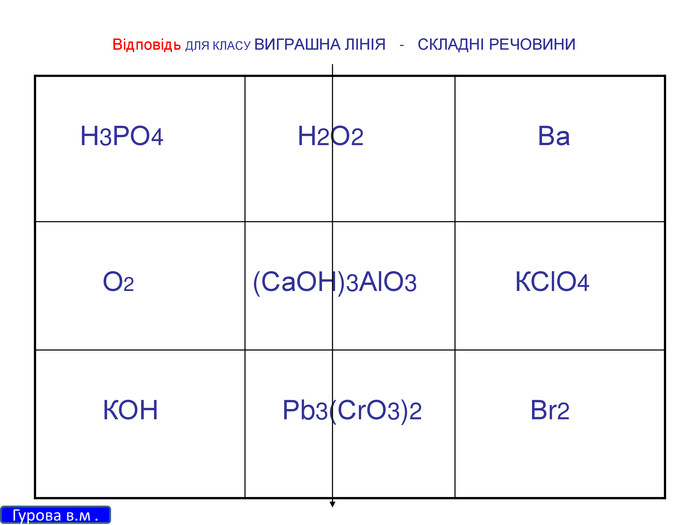























Зміст слайдів
ppt
Додав(-ла)
Гурова Валентина Миколаївна
Додано
25 грудня 2018
Переглядів
2060
Оцінка розробки
Відгуки відсутні


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку
Рекомендовані матеріали
Схожі матеріали