Презентація «Масова частка розчиненої речовини» 9 клас
Про матеріал
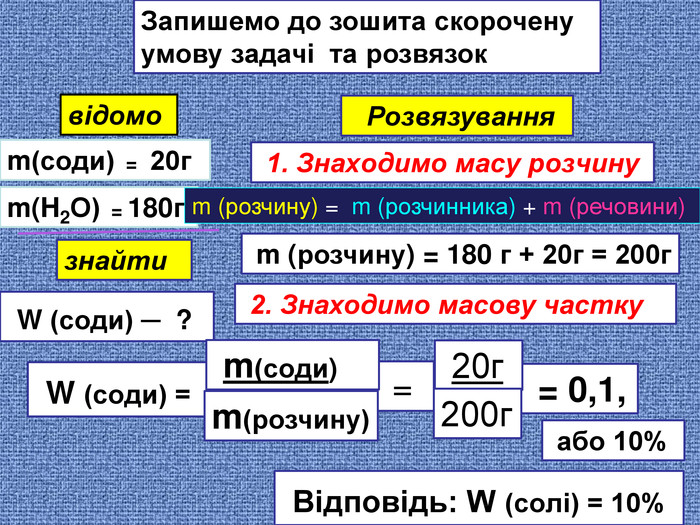
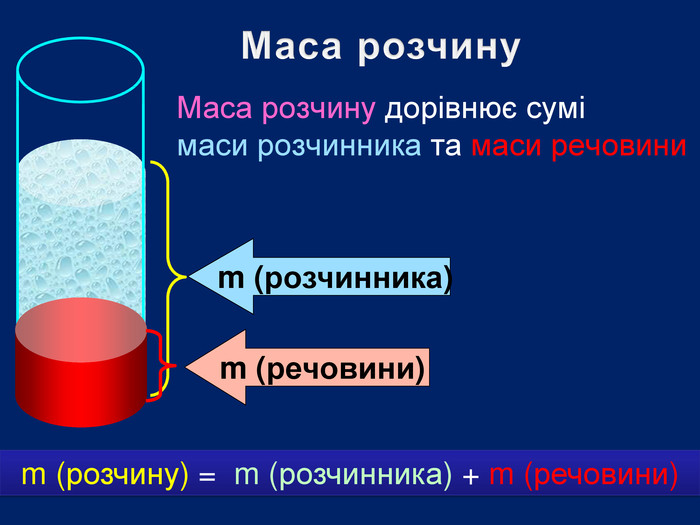
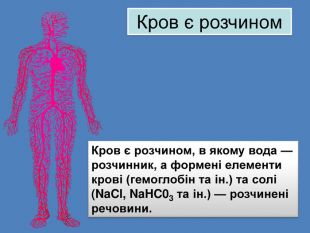
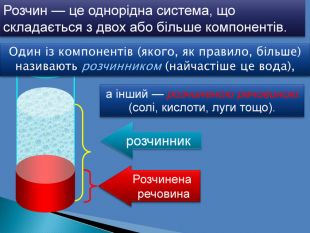
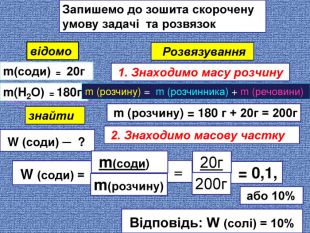
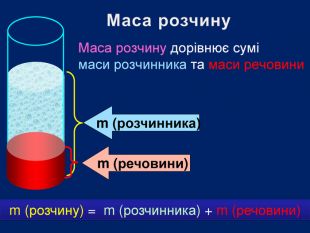
Презентація допоможе учням та вчителю при проведенні уроку на тему Розрахункові задачі 1. Розв'язування задач з певною масовою часткою розчиненої речовини. Приготування розчинів
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
-
-
Легко, доступно,цікаво, науково, інтегровано!!!
pptx
До підручника
Хімія 9 клас (Григорович О.В.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку