Презентація "Механізми клітинної смерті. Рак"
Про матеріал
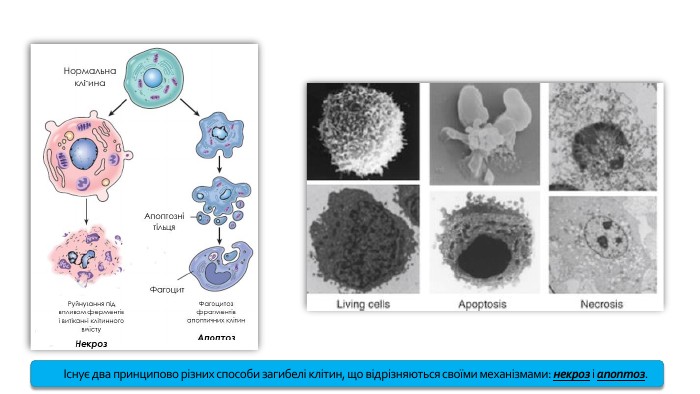
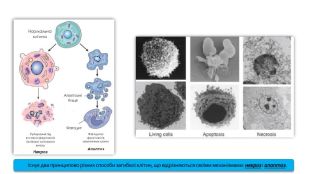
Існує два принципово різних способи загибелі клітин, що відрізняються своїми механізмами: некроз і апоптоз.
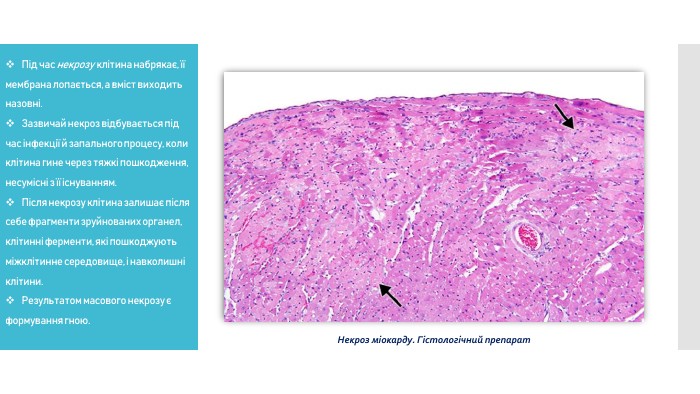
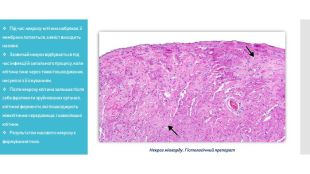
Під час некрозу клітина набрякає, її мембрана лопається, а вміст виходить назовні. Зазвичай некроз відбувається під час інфекції й запального процесу, коли клітина гине через тяжкі пошкодження, несумісні з її існуванням. Після некрозу вона залишає після себе фрагменти зруйнованих органел, клітинні ферменти, які пошкоджують міжклітинне середовище, і навколишні клітини. Результатом масового некрозу є формування гною.
Апоптоз (грец. apoptosis — опадання) — генетично запрограмована загибель клітини, в якій провідну роль відіграють внутрішньоклітинні механізми, що спричиняють «ретельне» розбирання і видалення клітини. За допомогою апоптозу здійснюється регуляція кількості клітин у тій чи іншій тканині як у процесі розвитку, так і в гомеостазі. У нормі апоптоз спрямований на видалення надлишково утворених клітин або клітин із серйозними порушеннями структури або функції генетичного апарата. Для клітин апоптоз виступає як ознака завершення її фізіологічної ролі або розвитку несумісних із подальшою життєдіяльністю біохімічних, морфологічних, функціональних змін. Для популяції клітин він є регулятором чисельності, способом оновлення або маркером розвитку патологічних змін у відповідному сегменті тканин чи органа.
Морфологічними ознаками апоптозу є фрагментація ДНК, ущільнення хроматину, наступний розпад клітинного ядра, поступова зміна об'єму і форми самої клітини внаслідок зморщування цитоплазматичної мембрани, а також фрагментація клітини на мембранні везикули. Ці везикули, які називаються апоптозними тільцями, у подальшому фагоцитуються макрофагами або сусідніми клітинами. Апоптоз — це процес, що спричиняє не лізис клітини, а її фрагментацію, розпад. При цьому не розвивається запальна реакція.
Значення апоптозу в організмі тварин і людини дуже велике. Апоптоз є вагомим фактором імунітету, оскільки загибель зараженої клітини може запобігти поширенню інфекції в організмі, хоча у деяких інфекційних агентів, напр. токсоплазмі, виробилися спеціальні механізми для запобігання передчасної загибелі заражених клітин. Апоптоз — це також один з основних механізмів самопрофілактики онкологічних захворювань. Шляхом апоптозу елімінуються трансформовані клітини, напр. при канцерогенній дегенерації, вірусній інфекції чи незворотному ушкодженні ДНК у разі опромінення.
Рак є наслідком порушення контролю клітинного циклу й клітинної смерті, що породжує нестаріючі клітини, які постійно діляться
Клітинний цикл у багатоклітинних організмів знаходиться під чітким генетичним контролем: перехід із фази до фази й проходження контрольних точок відбувається лише за певних умов. Проте, спонтанно, або під дією мутагенів (хімічних сполук, УФ і рентгенівського випромінювань, деякі віруси тощо) в клітинах можуть відбуватися генетичні мутації, що спричиняють порушення контролю за клітинними поділами. Така клітина може спонтанно багаторазово ділитися та породжувати подібні до себе, що призводитиме до формування пухлини.
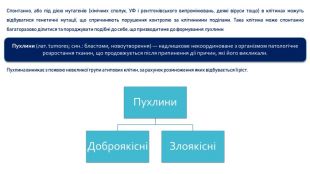
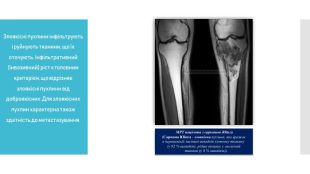
Пухлини (лат. tumores; син.: бластоми, новоутворення) — надлишкове некоординоване з організмом патологічне розростання тканин, що продовжується після припинення дії причин, які його викликали; складаються з якісно змінених клітин, атипових щодо диференціювання й характеру росту, які передають ці властивості своїм нащадкам. Пухлина виникає з появою невеликої групи атипових клітин, за рахунок розмноження яких відбувається її ріст. Основними ознаками пухлини є її атиповість (за будовою, розташуванням і взаємодією клітин пухлини різною мірою відрізняються від вихідної тканини), автономний ріст і прогресія.
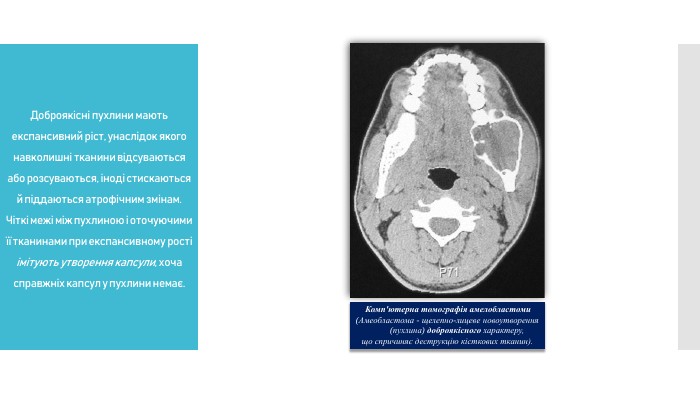
Розрізняють доброякісні та злоякісні пухлини. Доброякісні пухлини мають експансивний ріст, унаслідок якого навколишні тканини відсуваються або розсуваються, іноді стискаються й піддаються атрофічним змінам. Чіткі межі між пухлиною і оточуючими її тканинами при експансивному рості імітують утворення капсули, хоча справжніх капсул у пухлини немає.
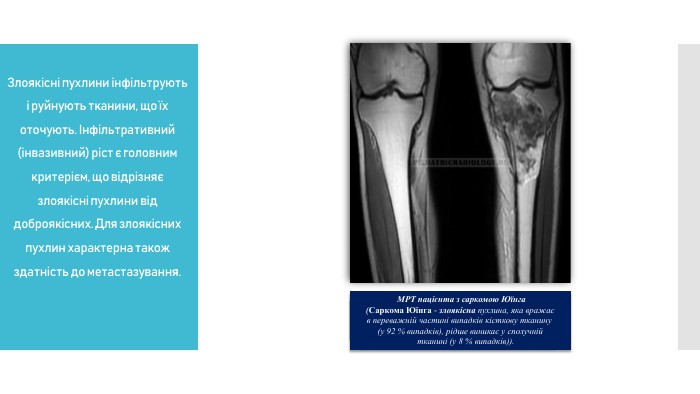
Злоякісні пухлини інфільтрують і руйнують тканини, що їх оточують. Інфільтративний (інвазивний) ріст є головним критерієм, що відрізняє злоякісні пухлини від доброякісних. Для злоякісних пухлин характерна також здатність до метастазування.
В етіології пухлини великого значення надають дії іонізуючого випромінювання, онкогенних речовин і вірусів, що в деяких випадках може бути сумісним. При цьому онкогенний ефект може посилюватися неонкогенними агентами й модифікуватися різними факторами. В етіології тих або інших пухлин можуть переважати різні етіологічні фактори. Так, наприклад, серед причин раку шкіри велике значення має УФ-випромінювання, серед причин раку легень найбільшого значення надають вдиханню онкогенних речовин із забрудненого ними атмосферного повітря, наприклад при палінні. Етіологія багатьох пухлини, наприклад раку тіла матки, зокрема, шийки матки, молочної залози, передміхурової, щитовидної залози, гіпофіза, надниркової залози та ін., базується на дисгормональних порушеннях організму.
Дихання пухлин в організмі послаблене через недостатнє постачання кисню, і основним джерелом енергії для неї є анаеробний гліколіз. Пухлини здатні «насмоктувати» глюкозу з крові. В цих умовах мобілізуються компенсаторні можливості організму — в першу чергу витрачаються запаси глікогену печінки та м'язів. Основним же процесом, що дозволяє організму в більшості випадків покривати втрати глюкози, що поглинається пухлиною, є глюконеогенез — ендогенне утворення глюкози в печінці та нирках з невуглеводних попередників. Може наступати глибока гіпоглікемія.
Ріст пухлини призводить до посиленої мобілізації ліпідів жирових депо і м'язів. Цей процес супроводжується гіперліпідемією як компенсаторною реакцією організму на гіпоглікемічний вплив пухлини, що дозволяє тканинам при нестачі глюкози використовувати окиснення жирних кислот як додаткове джерело енергії.
Методи діагностики раку
Фізикальне обстеження. Лікар може провести пальпацію певної частини тіла, перевіряючи наявність шишок, які можуть вказувати на рак. Під час фізикального обстеження лікар може шукати аномалії, такі як зміна кольору шкіри або збільшення певного органу, що також може вказути на рак.
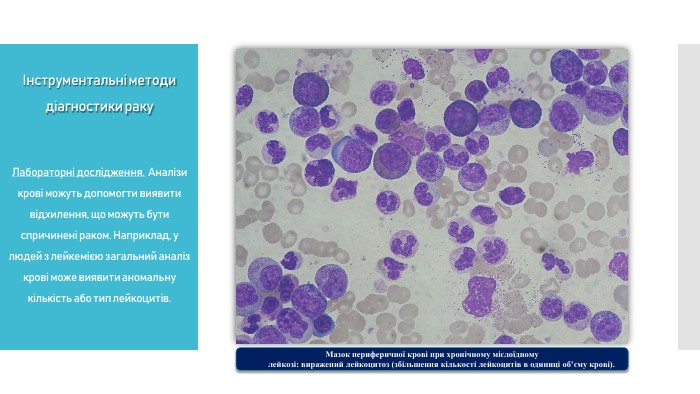
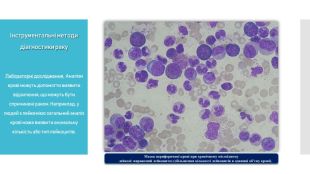
Лабораторні дослідження. Аналізи крові та сечі можуть допомогти виявити відхилення, що можуть бути спричинені раком. Наприклад, у людей з лейкемією загальний аналіз крові може виявити аномальну кількість або тип лейкоцитів.
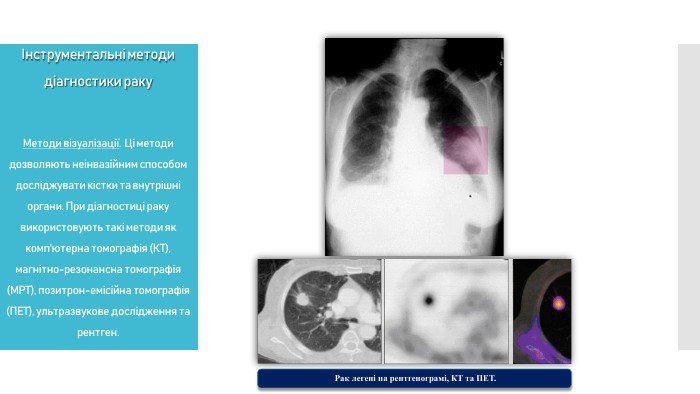
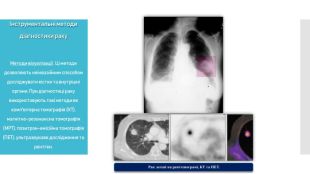
Методи візуалізації. Ці методи дозволяють неінвазивним способом досліджувати кістки та внутрішні органи. При діагностиці раку використовують такі методи як комп'ютерна томографія (КТ), магнітно-резонансна томографія (МРТ), позитрон-емісійна томографія (ПЕТ), ультразвукове дослідження та рентген.
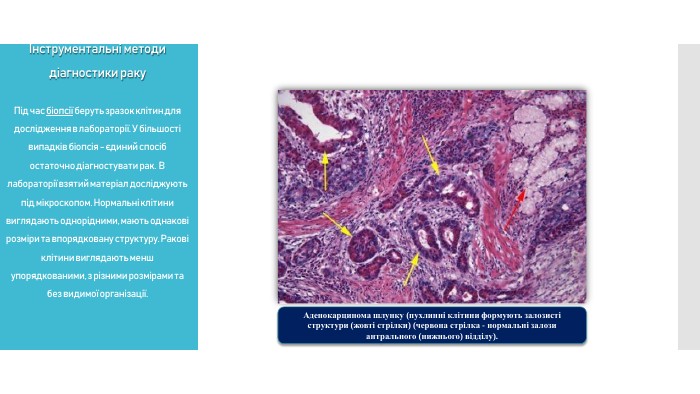
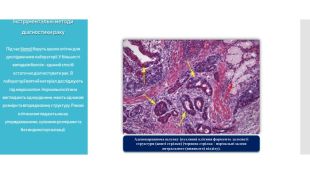
Біопсія. Під час біопсії беруть зразок клітин для дослідження в лабораторії. У більшості випадків біопсія - єдиний спосіб остаточно діагностувати рак. В лабораторії взятий матеріал досліджують під мікроскопом. Нормальні клітини виглядають однорідними, мають однакові розміри та впорядковану структуру. Ракові клітини виглядають менш упорядкованими, з різними розмірами та без видимої організації.
Методи лікування онкологічних захворювань
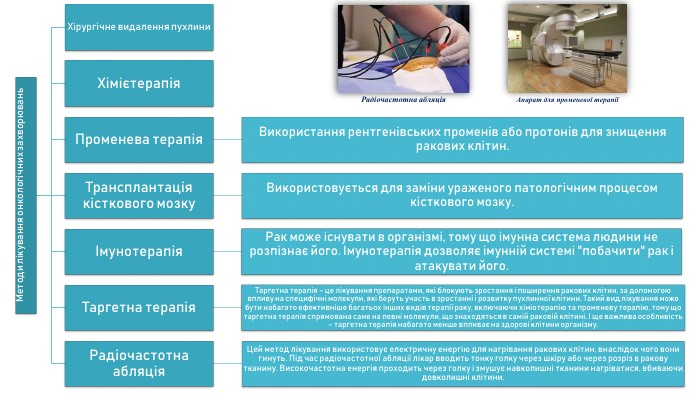
Хірургічне видалення пухлини.
Хімієтерапія.
Променева терапія. Використання рентгенівських променів або протонів для знищення ракових клітин.
Трансплантація кісткового мозку. Використовується для заміни ураженого патологічним процесом кісткового мозку.
Імунотерапія. Рак може існувати в організмі, тому що імунна система людини не розпізнає його. Імунотерапія дозволяє імунній системі "побачити" рак і атакувати його.
Гормональна терапія. Деякі види раку розвиваються під впливом гормонів організму. Як приклад можна навести рак молочної залози та рак простати. Видалення цих гормонів з організму або блокування їхньої дії може призвести до зупинки росту ракових клітин.
Таргетна терапія. Таргетна терапія – це лікування препаратами, які блокують зростання і поширення ракових клітин, за допомогою впливу на специфічні молекули, які беруть участь в зростанні і розвитку пухлинної клітини. Такий вид лікування може бути набагато ефективніше багатьох інших видів терапії раку, включаючи хіміотерапію та променеву терапію, тому що таргетна терапія спрямована саме на певні молекули, що знаходяться в самій раковій клітині. І ще важлива особливість – таргетна терапія набагато менше впливає на здорові клітини організму.
Радіочастотна абляція. Цей метод лікування використовує електричну енергію для нагрівання ракових клітин, внаслідок чого вони гинуть. Під час радіочастотної абляції лікар вводить тонку голку через шкіру або через розріз в ракову тканину. Високочастотна енергія проходить через голку і змушує навколишні тканини нагріватися, вбиваючи довколишні клітини.
Розробка нових методів лікування. На сьогодні розробляють нові, експериментальні способи лікування раку, більш специфічні стосовно ракових клітин, тому не мають таких побічних ефектів, як хіміо- і радіотерапія. Наприклад, колоїдне золото може використовуватися для лікування багатьох форм раку. До організму вводять суспензію наночастинок золота, які розносяться тканинами. Ракові клітини, що швидко ростуть, оточують і поглинають ці частинки. Після дії ультразвуку або вихрового магнітного поля частинки розігріваються до сотень градусів та вбивають ракові клітини зсередини. Революційним проривом у лікуванні раку став метод модифікації лімфоцитів поза організмом. Лімфоцити людини, хворої на рак, ізолюють із крові, «навчають» їх розпізнавати й знищувати ракові клітини, після чого повертають назад до організму. Цей метод дає чудові результати, але поки є вкрай дорогим і все ще знаходиться у стані розробки. Також нині розробляють методи адресної доставки ліків: лікувальний препарат прикріплюють до переносника, що доставляє молекулу безпосередньо до ракової клітини та забезпечує прицільну дію.
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку