Урок узагальнення знань з теми "Хімічний зв'язок і будова речовини"
Тема. Узагальнення та систематизація знань з теми: «Хімічний зв'язок і будова речовин»
Мета:
- узагальнити й систематизувати знання учнів про види хімічного зв'язку й типи кристалічних ґраток з погляду будови атома; продовжити формування елементів наукового світогляду учнів, багатогранності та єдності будови речовини, взаємозв'язку явищ у природі;
- розвивати вміння й навички учнів застосовувати отримані знання для виконання завдань;
- виховувати любов до предмету, підготувати учнів до контрольної роботи з теми «Хімічний зв'язок і будова речовини».
Державні вимоги до рівня загальноосвітньої підготовки учнів:
Учень:
- називає види хімічного зв’язку, типи кристалічних ґраток;
-наводить приклади сполук із ковалентним (полярним і неполярним) та йонним хімічним зв’язком, атомними, молекулярними та йонними кристалічними ґратками;
-розрізняє валентність і ступінь окиснення елемента;
-пояснює утворення йонного, ковалентного (полярного і неполярного) зв’язків;
-характеризує особливості ковалентного та йонного зв’язків, кристалічної будови речовин з різними видами хімічного зв’язку;
-обґрунтовує природу хімічних зв’язків; фізичні властивості речовин залежно від їхньої будови;
-прогнозує властивості речовин залежно від виду хімічного зв’язку і типу кристалічних ґраток;
-визначає ступені окиснення елементів у сполуках за їх формулами, вид хімічного зв’язку в типових випадках, полярність ковалентного зв’язку;
-складає електронні формули молекул, хімічні формули бінарних сполук за ступенями окиснення елементів;
-використовує поняття електронегативності для характеристики хімічних зв’язків.
Обладнання: Періодична система хімічних елементів Д. І. Менделеева, таблиця електронегативностей, роздатковий матеріал
Базові поняття і терміни:хімічний зв’язок, електронегативність, ковалентний неполярний та полярний зв’язок, йонний зв’язок, електрон, електронегативність.
Тип уроку: узагальнення й систематизація знань, умінь і навичок.
Хід уроку
І. Організаційний момент.
Взаємне вітання вчителя й учнів, організація уваги та психологічне налаштування учнів на продуктивну роботу. Клас поділяють на дві команди, які обирають капітанів, вибирають назву для команд, роблять коротку презентацію команд.
Кожна команда отримує таблицю для оцінювання (додаток).
ІІ. Мотивація навчальної діяльності
Десь у світі Періодичної системи живуть собі атоми. Живуть-поживають, а щастя не мають. І ніби все в них є, немає тільки відчуття гармонії, стабільності. Ви, може, ще й не знаєте, але все в цьому світі прагне досконалості.
До якого стану прагнуть усі атоми?
Для атомів такою досконалістю є заповнена зовнішня електронна оболонка, інакше кажучи, кожен атом на зовнішньому рівні прагне мати вісім електронів, як поважаючий себе інертний газ. Такий октет є стабільним, він дозволяє атому почувати себе захищеним і мати найменшу енергію.
То які частинки постійно прагнуть віддати або прийняти атоми?
Так, це електрони, отже вони і стануть винагородою за виконані вами вправи.
ІІ. Узагальнення і систематизація знань.
1. Розминка для команд (бліц-питання)(по 1 електрону за правильну відповідь)
- Яку властивість атома називають електронегативністю?
- Як змінюється електронегативність у групах?
- Як змінюється електронегативністю у періодах?
- Який зв’язок атомів називають ковалентним?
- В яких речовинах виникає ковалентний неполярний зв’язок?
- В яких речовинах виникає ковалентний полярний зв’язок?
- Між атомами яких елементів виникає йонний зв’язок?
- Як утворюються позитивно заряджені йони?
- Як утворюються негативно заряджені йони?
10. Від чого залежить величина заряду йона?
2. Конкурс сортування
https://wordwall.net/ru/resource/26487850

3. Конкурс «Математичний»
За даними формулами знайти хімічний елемент:
І команда:
a2 – (b-c) = Nпор Е (порядковий номер елемента)
- кількість нейтронів в атомів Літію;
b - протонне число атома Фосфору;
c - загальна кількість електронів в атомів Карбону
Відповідь: Нітроген
ІІ команда:
a + (b2 -c) = Nпор Е
a– протонне число Силіцію;
b– заряд ядра атома Бору;
c - загальна кількість електронів в атомів Оксигену
Відповідь: Галій.
4. Кольоровий конверт.
1 конверт. Завдання: у перекладі з грецької означає непохитний, твердий. За фізичними властивостями кристалічна речовина, тугоплавка, не проводить електричний струм. Кристали можуть бути безбарвні прозорі. Цією речовиною перський уряд, щоб «уласкавити білого царя», розплатився за кров відомого російського дипломата і видатного письменника О. С. Грибоєдова, полеглого від рук розлюченого натовпу у 1829р. в Тегерані.
Відповідь: Алмаз, атомна кристалічна ґратка.
2 конверт: біла кристалічна речовина, тугоплавка, добре розчиняється у воді, розчин проводить електричний струм. Відсутність цієї речовини в раціоні наполеонівських солдатів під час їхнього відступу з Москви стало причиною різкого збільшення смертності від поранень. У давні часи в Китаї з неї навіть виготовлялись монети.
Відповідь : кухонна сіль.
3 конверт: тверда аморфна речовина, прозора складаються з сплавів різних силікатів. За загально складеною історичною думкою технології виготовлення вперше почали використовувати близько 2500—3000 рр. до н. е. у Єгипті. Близько 1500 років до н. е. у Єгипті з цієї речовини почали виготовляти перші предмети домашнього вжитку. Це в основному були чаші, кухонне начиння та пляшки.
Відповідь :Скло.
4 конверт. Проста речовина неметалічного походження. В перекладі з грецького означає схожий кольором на фіалку, фіолетовий. За нормальних умов утворює кристали чорно-сірого кольору з металічним блиском. Має молекулярну кристалічну решітку. Нестача його в організмі людини призводить до комплексного розладу здоров'я, що є одним з найпоширеніших у світі неінфекційних захворювань. У медицині як антисептик використовується 5 % спиртовий розчин.
Відповідь :Йод
5 конверт Аморфна речовина, природна скам'яніла викопна смола хвойних чи покритонасінних дерев у вигляді тьмяних, прозорих і напівпрозорих каменів. Використовується для виготовлення ювелірних прикрас, у парфумерії, народній медицині та електриці. Має велике значення для палеонтології завдяки збереженню в ній потонулих у смолі істот.
Відповідь :Бурштин
Завдання 4.
І команда
Атом елемента має на 9 електронів менше, ніж йон Кальцію Ca 2+. Назвіть цей елемент, складіть електронні формули цього атома.
ІІ команда
Атом елемента має на 5 електронів менше, ніж йон Сульфуру S 2-. Назвіть цей елемент, складіть електронні формули його атома.
Завдання 5
Кросворд
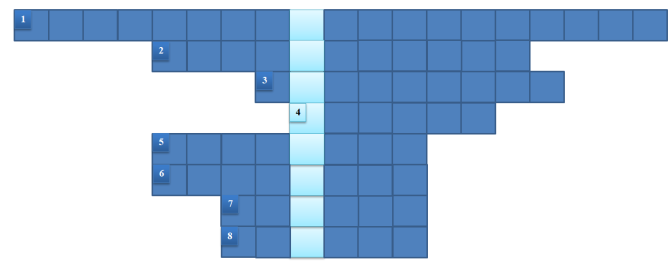
Запитання
- Як називається властивість атома відтягувати на себе електронну густину?
- Зв’язок між атомами, зумовлений утворенням спільних електронних пар.
- Кристалічна ґратка, у вузлах якої містяться катіони металів.
- Як називається позитивно заряджений йон?
- Як називають частину простору в атомі, де перебування електрона найімовірніше?
- Один із видів ковалентного зв’язоку, у якому одна чи кілька спільних електронних пар зміщені в бік одного з атомів.
- Яку кристалічну ґратку має кварц?
- Хімічний зв’язок, який виникає між протилежно зарядженими йонами в речовині називають…
Завдання 6.
Записати графічні електронні формули таких молекул: Na2O, H2S, N2
Записати графічні електронні формули таких молекул: О2, КС1, K2S
Завдання 7. Хрестики-нулики
Вказати на фізичні властивості речовин з атомними кристалічними ґратками
|
Висока міцність
|
Низька міцність |
Леткість |
|
Середня твердість
|
Висока твердість |
Низька твердість |
|
Проводять електричний струм
|
Розчинні у воді |
Висока температура плавлення |
Вказати на фізичні властивості речовин з молекулярними кристалічними ґратками
|
Леткі |
Мають високу твердість |
Пластичні |
|
Низькі температури плавлення |
Мають дуже високі температури плавлення |
Мають високі температури кипіння |
|
Низькі температури кипіння |
Мають металічний блиск |
Пластичні |
Завдання 8. Розв’язок задач
№1 Відносна молекулярна маса вищого оксиду елемента ІV групи головної підгрупи дорівнює 44. Визначте елемент.
Відповідь: С - Карбон
№2 Елемент, який належить до VІ групи періодичної системи, утворює вищий оксид, відносна молекулярна маса якого становить 80. Визначте елемент.
Відповідь: Сульфур
V. Підведення підсумків уроку.
Ми закріпили знання про будову речовин.
1. Яке значення для вивчення хімії має теорія хімічного зв’язку й будови речовини?
2. Де практично можна використати знання про типи хімічного зв’язку й кристалічних ґраток?
3. Як взаємозалежать типи хімічного зв’язку, кристалічна будова і властивості речовин?
4. Які знання ми узагальнили на уроці?
Підбиваємо підсумки уроку, оцінюємо роботу .
VІ. Домашнє завдання.
Повторити матеріал підручника, підготуватися до контрольної роботи.
Додаток А
|
№ |
Прізвище та ім’я учасника команди |
Кількість набраних балів |
Оцінка |
|
1 |
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
|
4 |
|
|
|
|
5 |
|
|
|
|
6 |
|
|
|
|
7 |
|
|
|
|
8 |
|
|
|
|
9 |
|
|
|
|
10 |
|
|
|
|
11 |
|
|
|


![]()




Вказати на фізичні властивості речовин з атомними кристалічними ґратками
|
Висока міцність
|
Низька міцність |
Леткість |
|
Середня твердість
|
Висока твердість |
Низька твердість |
|
Проводять електричний струм
|
Розчинні у воді |
Висока температура плавлення |
Вказати на фізичні властивості речовин з молекулярними кристалічними ґратками
|
Леткі
|
Мають високу твердість |
Пластичні |
|
Низькі температури плавлення
|
Мають дуже високі температури плавлення |
Мають високі температури кипіння |
|
Низькі температури кипіння
|
Мають металічний блиск |
Пластичні |







про публікацію авторської розробки
Додати розробку
