Презентація на тему"Алкани,Алкени"
Про матеріал
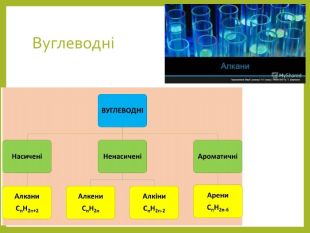
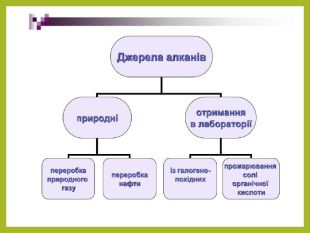
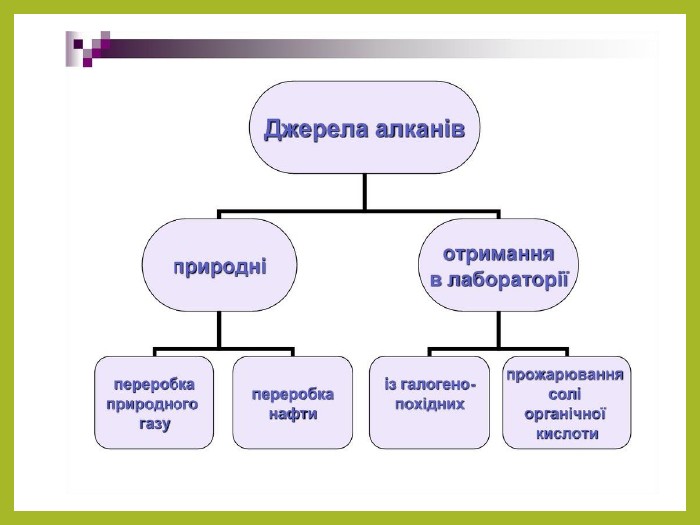
Основні природні джерела алканів – нафта і природний газ. В останньому вміст
метану становить близько 98%, решта – етан, пропан, бутан та інші вуглеводні. Для
добування алканів нафту піддають переробці.
В промисловості насичені вуглеводні добувають з нафти фракціонуванням або
крекингом. Перегонка дозволяє виділити алкани, які були присутні в нафті, а в
процесі крекігу відбувається розрив С-С зв'язків, в результаті чого утворюються
вуглеводні з меншою молекулярною масою, ніж вихідні. Нижчі гомологи алканів
часто добувають з природного газу. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку








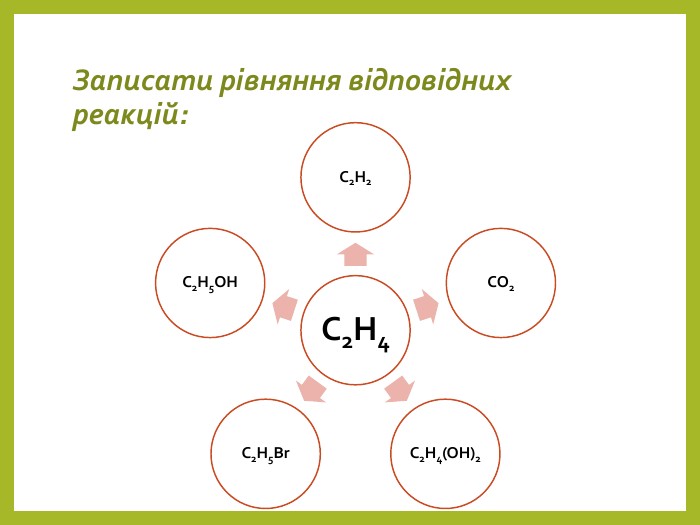
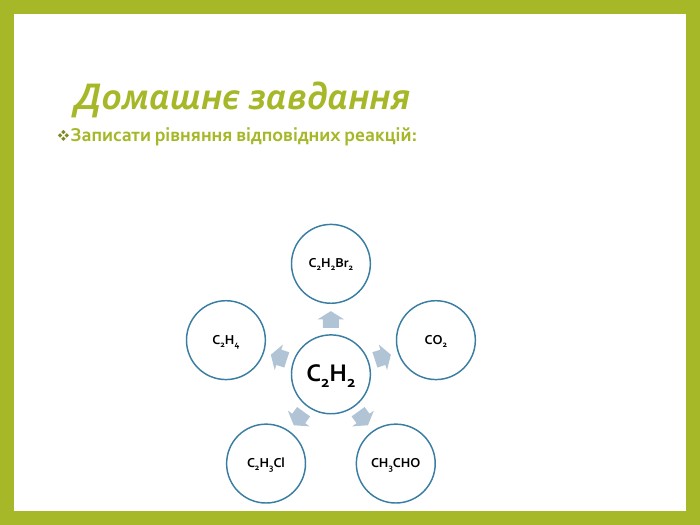
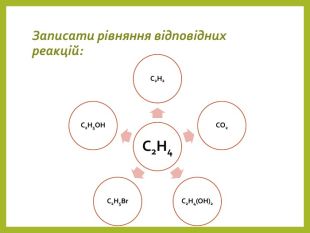
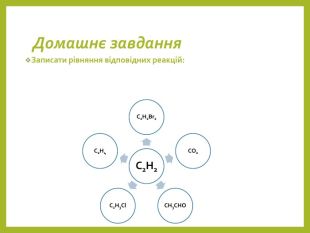
![Дописати рівняння. C2 H4 + 3 O2 → 2 CO2 + 2 H2 OC2 H4 → C2 H2 + H2 C2 H4 + H2 O → C2 H5 OHC2 H4 + HBr → C2 H5 Br. C2 H4 + [O]→ C2 H4(OH)2 Дописати рівняння. C2 H4 + 3 O2 → 2 CO2 + 2 H2 OC2 H4 → C2 H2 + H2 C2 H4 + H2 O → C2 H5 OHC2 H4 + HBr → C2 H5 Br. C2 H4 + [O]→ C2 H4(OH)2](/uploads/files/750819/312415/343003_images/14.jpg)