презентація на тему: "Білки"
Про матеріал
Розробка уроку на тему: "Білки".
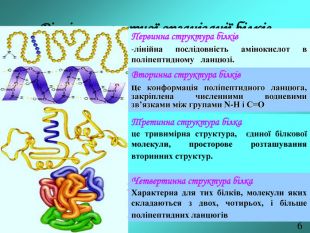
Тема. Білки: будова, властивості, перетворенні у процесі харчування.
Мета. Ознайомити учнів з харчовими та біологічними цінностями білків,
структурою, властивостями, методами визначення білків та новими формами
білкової їжі. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку