Урок "Розв’язування задач на знаходження хімічної формули речовини за відомими масою, об’ємом, кількістю речовини ─ продуктів згорання."
Урок хімії 10 кл
Тема. Розв’язування задач на знаходження хімічної формули речовини за відомими масою, об’ємом, кількістю речовини ─ продуктів згорання .
Мета: засвоїти новий тип розрахункових задач: розв’язування задач на знаходження хімічної формули речовини за відомими масою, об’ємом, кількістю речовини ─ продуктів згорання; сформувати навички і вміння розв’язувати задачі даного типу; розвивати логічне мислення та самостійність розв’язанні задач.
Обладнання: плакат з поопераційним алгоритмом розв’язку задачі даного типу.
Тип уроку: засвоєння навичок та умінь.
Форми роботи: фронтальна робота за алгоритмом, виконання індивідуальних задач даного типу.
Хід уроку
І. Підготовка до уроку.
Учні отримують картки з алгоритмом розв'язку задач.
ІІ. Актуалізація та налаштовування учнів.
Повторення опорних знань для розв’язування задач.
- Що таке кількість речовини?
- Як обчислюється кількість речовини через масу?
- Як обчислюється кількість речовини через об’єм?
- Що таке молярний об’єм?
- Розв’язати задачі усно:
- Скільки грам Гідрогену містить молекула метану?
- Скільки грам Карбону містить молекула метану?
- Скільки грам Гідрогену містить молекула ацетилену?
- Скільки грам Карбону містить молекула ацетилену?
- Скільки грам Гідрогену містить 1моль етилену?
- Скільки грам Карбону містить 22,4л етилену?
ІІІ. Мотивація навчальної діяльності учнів:
Вчитель:
Ми з вами вже вміємо знаходити хімічні формули, якщо відомі масові частки елементів, які входять в дану речовину. При цьому нагадую вам, що дуже важливим фактом є дані про відносну густину парів цієї речовини. Сьогодні ми будемо вчитися розв’язувати задачі на знаходження хімічної формули речовини за відомими масою, об’ємом, кількістю речовини ─ продуктів згорання .
Ці задачі мають аналітичний характер, бо по кількості продуктів згорання можна визначити формулу речовини. Вміння розв’язувати ці задачі дозволить вам не тільки отримати високі оцінки, а й розвине вашу уяву та мислення. Задачі даного типу входять до завдань ЗНО з хімії.
IV. Вивчення нового матеріалу.
1. Проводимо фронтальне пояснення розв’язування задачі.
Вчитель пояснює алгоритм розв’язку задачі (на картках №1).
Задача №1
У результаті згоряння 1,76г органічної речовини утворилось 3,52г карбон ( IV) оксиду і 1,44г води. Густина парів цієї речовини за повітрям дорівнює 1,52. Виведіть молекулярну формулу органічної речовини.
Картка №1 Алгоритм розв'язку задачі
|
Дано :
m (реч) = 1,76 г
m (СО2) = 3,52 г
m (Н2О) = 1,44 г
D (пов) = 1,52
СХНУОZ ─ ?
|
Хід розв’язку МХ D = ─── ; МХ = D·М (пов) М (пов) m (СО2) або V (СО2) · Ar (С) m (С) = ─────────────── М (СО2) або VМ m (Н2О) · 2 Ar (Н) m (Н) = ──────────── М (Н2О)
m (О) = m (реч) ─ m (Н) ─ m (С) m (С) m (Н) m (О) Х : У : Ζ = ─── : ─── : ── Ar (С) Ar (Н) Ar (О) МХ n (СХНУОZ ) = ────── М (СХНУОZ)
|
Додаткові дані
Ar (С) = 12 г/моль
Ar (Н) = 1 г/моль
М (пов) = 29 г/моль . М (СО2) = 44 г/моль
М (Н2О) = 18 г/моль
VМ = 22,4 л /моль |
Вчитель записує задачу на дошці та пояснює її розв’язування.
Дано : Розв’язок:
![]() m (реч) = 1,76 г 1. Визначаємо відносну молекулярну масу
m (реч) = 1,76 г 1. Визначаємо відносну молекулярну масу
вуглеводню за формулою:
m (СО2) = 3,52 г МХ = D·М (пов) = 1,52 * 29 г/моль = 44 г/моль.
2. Визначаємо масу Карбону, який згорів:
m (Н2О) = 1,44 г 3,52 * 12
m (С) = ─────── = 0,96г
D (пов) = 1,52 44
![]() 3. Визначаємо масу Гідрогену, який згорів:
3. Визначаємо масу Гідрогену, який згорів:
СХНУОZ ─ ? 1,44 * 2
m (Н) = ──────── = 0,16г
18
4. Визначаємо чи є у формулі Оксиген: m (О) = 1,76г ─ 0,96г ─ 0,16г = 0,64г
5. Визначаємо найменші індекси:
0,96 0,16 0,64
Х : У : Ζ = ── : ── : ── = (0,08 : 0,16 : 0,04) / 0,04 = 2 : 4 : 1
12 1 16
С2Н4О ? Визначаємо молекулярну масу: М (С2Н4О) = 44 г/моль
МХ = М (С2Н4О) = 44 г/моль
Відповідь: С2Н4О
2. Складаємо разом з учнями поопераційний алгоритм розв’язку задачі:
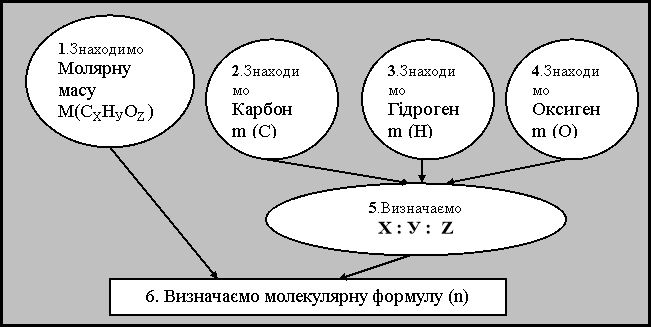
3. Пропонуємо учням розв’язати задачу№1 та №5 для І-ІІ варіантів. Робота в у стандартних умовах.
|
Задача №1
m (реч) = 10г МХ = D·М (О2) = 0,5* *32 г/моль= 16 г/моль m (СО2) = 27,5г 27,5*12 m (С) = ──── = 7,5г m (Н2О) = 22,5г 44 22,5*2 m (Н) = ───── = 2,5г D (О2) = 0,5 18
СХНУОZ ─ ? 7,5 2,5 Х : У = ── : ── =( 0,625:2,5)/ 0,625 = 12 1 = 1 : 4 (СН4) МХ = М (СН4) = 16 г/моль Відповідь: СН4 |
Задача№5 Дано:
2 г/моль= 78 г/моль m (СО2) = 2,2г 2,2*12 m (С) = ──── = 0,6г m (Н2О) = 0,45г 44 0,45* 2 D (Н2) = 39 m (Н) = ───── = 0,05г 18
СХНУОZ ─ ? 0,6 0,05 Х : У = ── : ── = (0,05 : 0,05)*100 =1 : 1 12 1 М (С1Н1) = 13 г/моль 78 г/моль n (СХНУ ) = ────── = 6 ( С6 Н6 ) 13 г/моль Відповідь: С6Н6 |
- Взаємоперевірка розв’язків у парах та коментарі із записом на дошці.
V. Застосування знань учнів у нестандартних умовах.
Учні розв’язують задачу з ускладненою умовою.
Задача № 3
В результаті спалювання 112мл газу утворилося 448мл карбон ( IV) оксиду (н.у.) і 0,45г води. Густина речовини за воднем 29 . Зайдіть молекулярну формулу газу.
![]() Дано:
Дано:
V (реч) = 112мл= МХ = D·М (Н2) = 29*2 г/моль =58 г/моль
=0,112л m (реч) = ν * Мх ; ν = V/ VМ Мх* V 58*0,112
V (СО2) = 448мл= m (реч) = ───── = ───── = 0,29г
= 0,448л VМ 22,4
m (Н2О) = 0,45г 0,448 * 12
m (С) = ─────── = 0,24г
D (Н2) = 29 22,4
![]() 0,45 * 2
0,45 * 2
СХНУОZ ─ ? m (Н) = ──────── = 0,05г
18
m (О) = 0,29г ─ 0,24г ─ 0,05г = 0
0,24 0,05
Х : У = ── : ── = (0,02 : 0,05)* 100 = 2 : 5
12 1 МХ 58 г/моль
М (С2Н5) = 29 г/моль n (СХНУ ) = ────── = ────── = 2 (С4Н10)
М (С2Н5) 29 г/моль
Відповідь: С4Н10
VІ. Закріплення.
Учні самостійно озвучують поопераційний алгоритм розв’язування задач даного типу.
Робота в парах.
Розв'язування задач:
1. При спалюванні 10г органічної речовини утворюється 27,5г вуглекислого газу і 22,5г води. Відносна густина пари речовини за киснем дорівнює 0,5. Виведіть молекулярну формулу речовини.
2. В результаті спалювання 112мл газу утворилося 448мл карбон ( IV) оксиду (н.у.) і 0,45г води. Густина речовини за воднем 29 . Зайдіть молекулярну формулу газу.
VІІ. Підбиття підсумків.
Вчитель аналізує роботу учнів на уроці, називає найактивніших учнів, оцінює роботу учнів, дякує за урок.
VІІІ. Завдання додому.

про публікацію авторської розробки
Додати розробку
