Презентація "Розв'язування вправ з теми "Метали та їх сполуки""
Про матеріал
Презентація містить матеріал для повторення та вправи на узагальнення знань про метали та їх сполуки. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Я бачу помилки в обчисленнях задач... То маса речовини 6,3 г, а ви рахуєте на 6,9 г. То кількість моль соляної кислоти 0,2 моля, а ви звідкись ділите 0,5 моль/2 і ще й у вас виходить 0,1 моль... Чи це для того, щоб вчителі не бездумно скачували і використовували, а ще й самі сіли, перевірили і переробили?...

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку












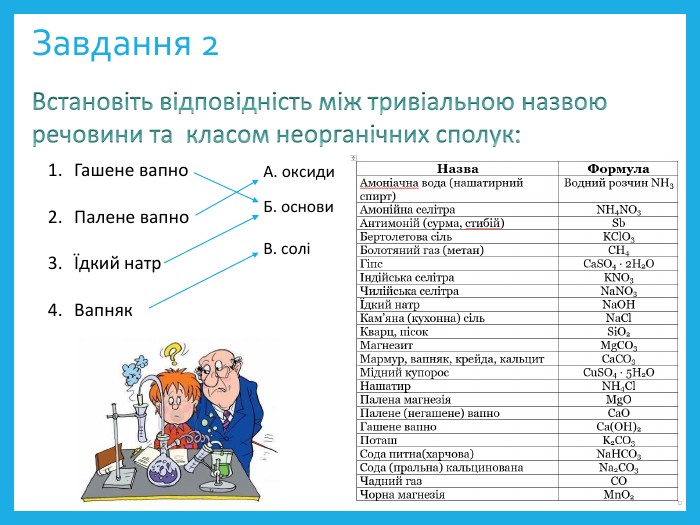
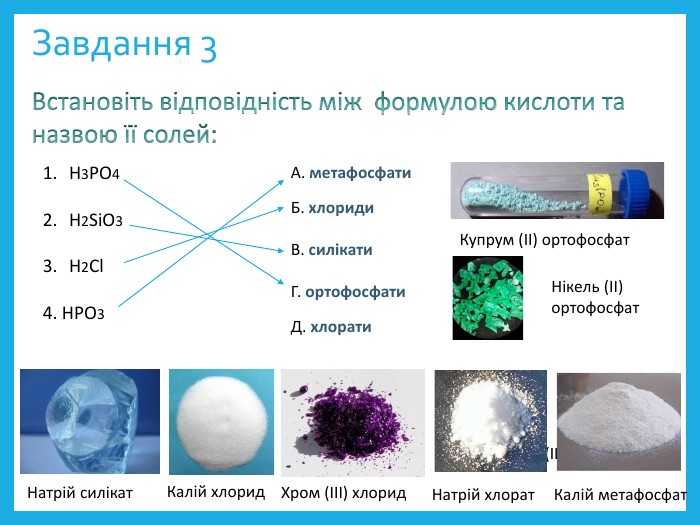
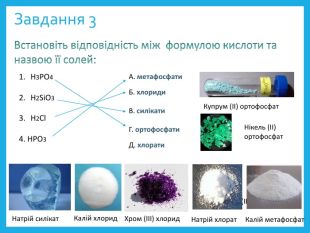
![Завдання 4 Встановіть відповідність між формулою солі та типом: Са. СО3 Са. НРО4 K3[Fe (CN)6]4. Сu2(OH)2 CO3 А. комплексні соліБ. середні солі В. подвійні соліГ. кислі соліД. основні солі Берлінська лазур (комплексна сіль)Фосфорні добрива (кислі солі) Завдання 4 Встановіть відповідність між формулою солі та типом: Са. СО3 Са. НРО4 K3[Fe (CN)6]4. Сu2(OH)2 CO3 А. комплексні соліБ. середні солі В. подвійні соліГ. кислі соліД. основні солі Берлінська лазур (комплексна сіль)Фосфорні добрива (кислі солі)](/uploads/files/172593/333179/374526_images/14.jpg)