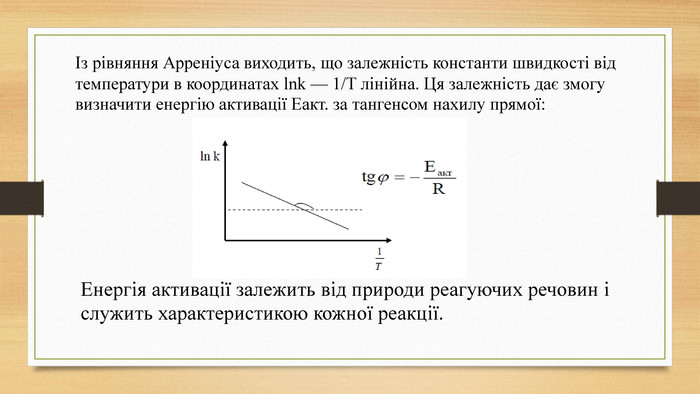
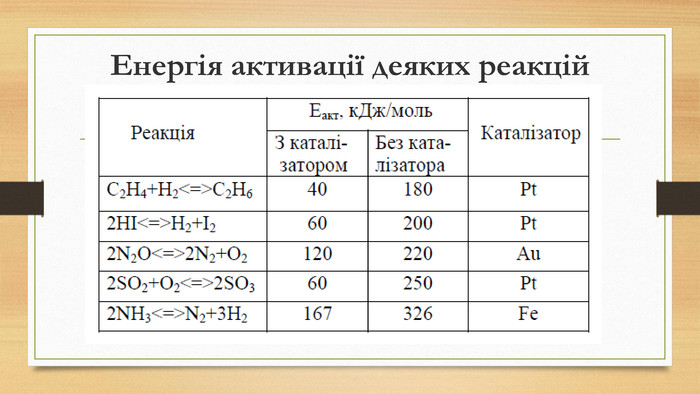
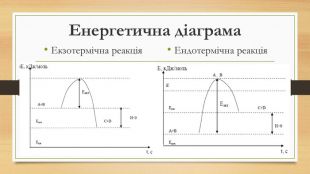
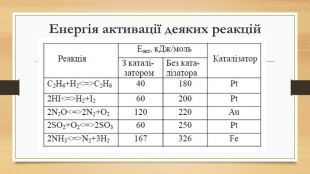
Презентація на тему: Хімічна кінетика
Про матеріал
Презентація містить теоретичний матеріал, а також посилання на навчальні відео Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку