Презентація на тему "Хімічні реакції. тепловий ефект"
Про матеріал
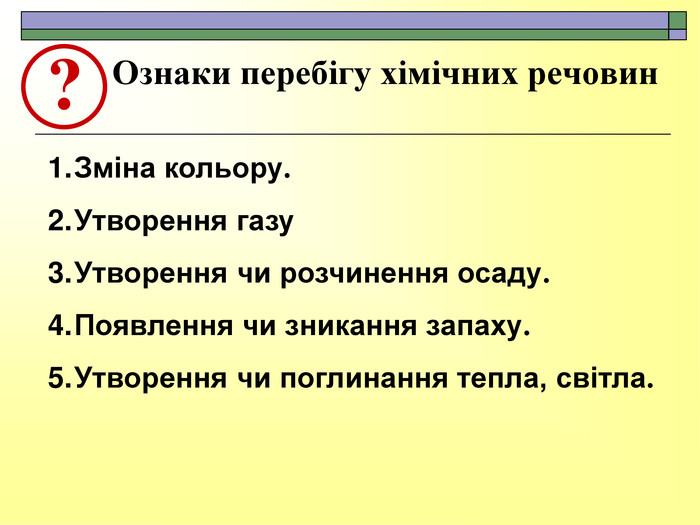
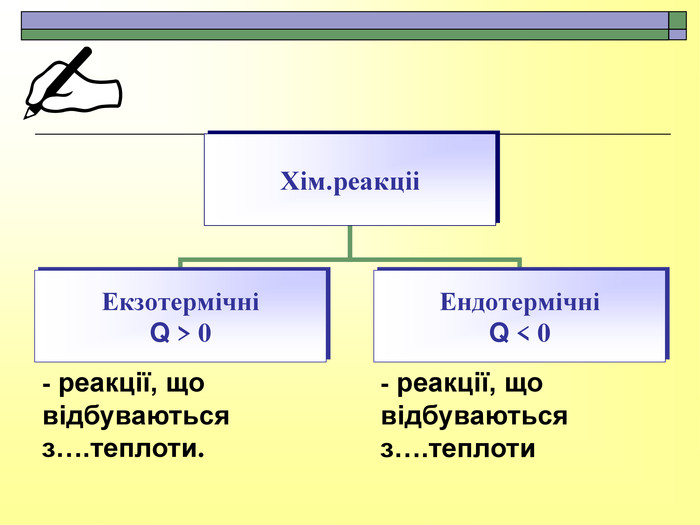
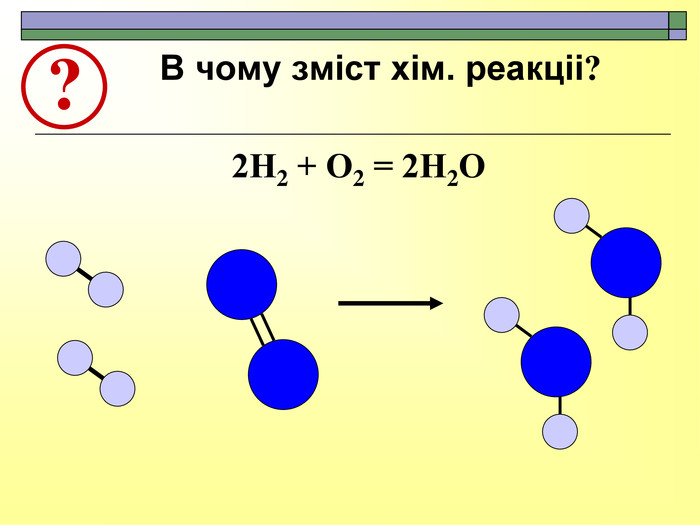
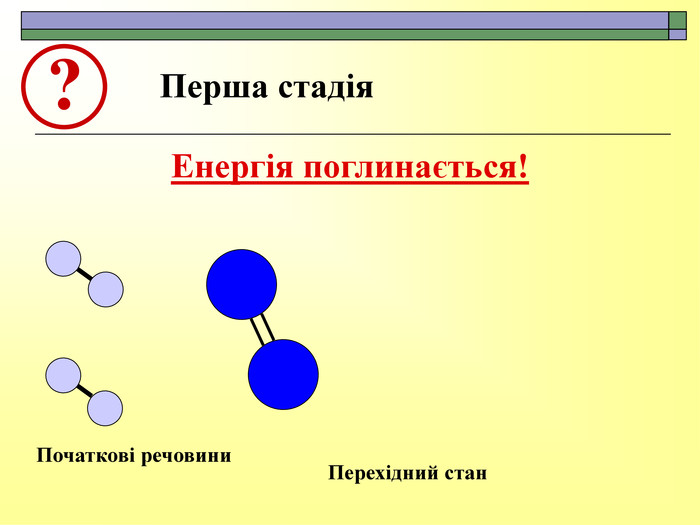
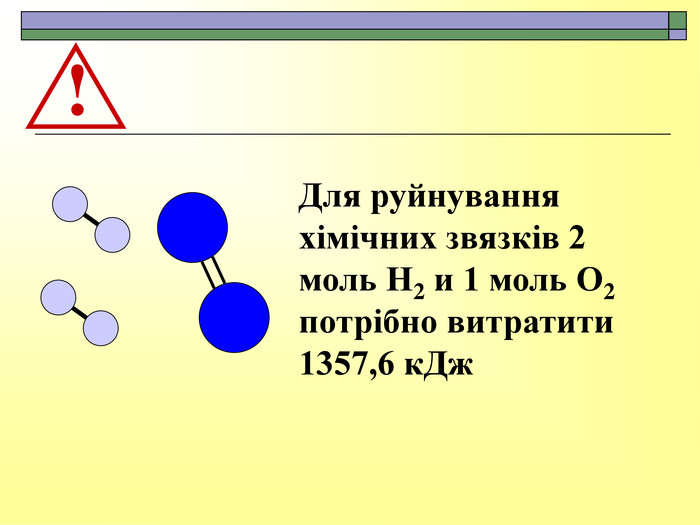
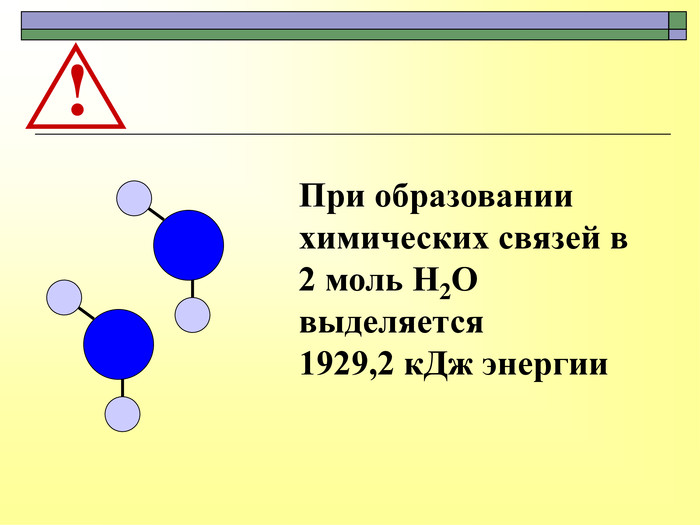
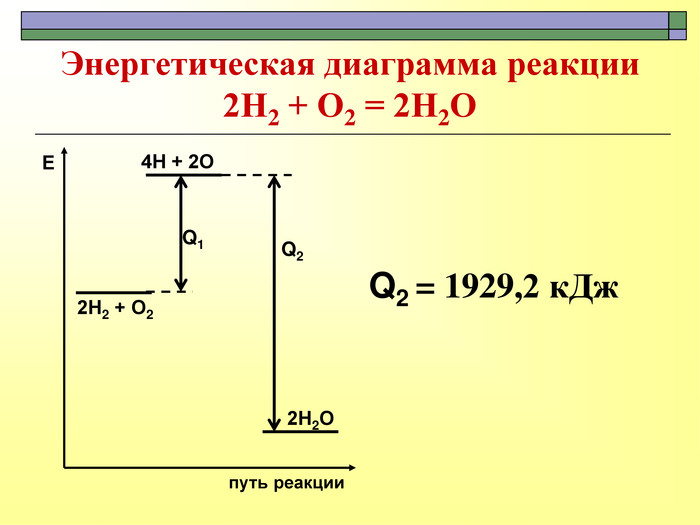
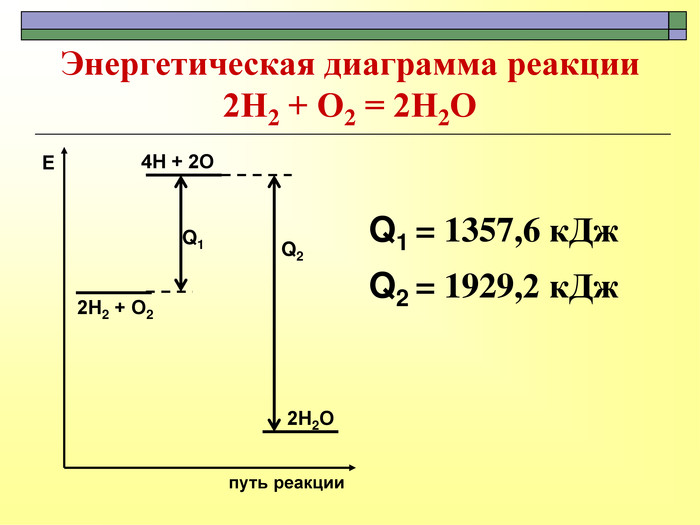
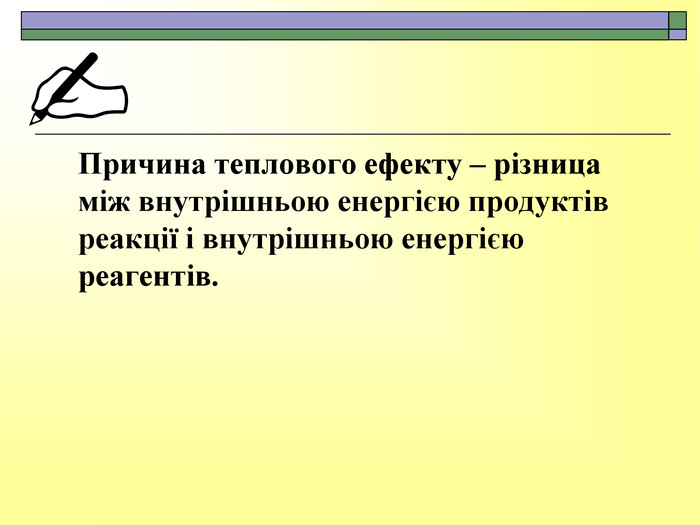
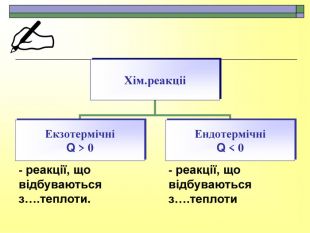
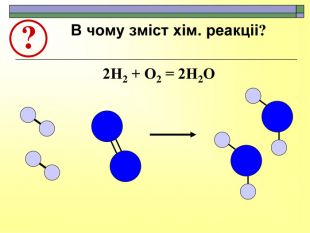
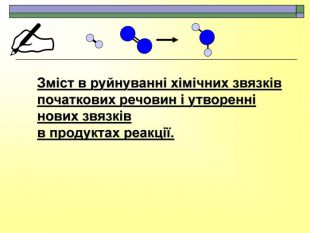
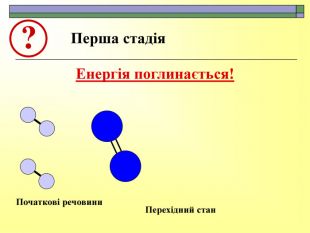
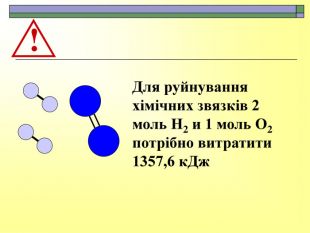
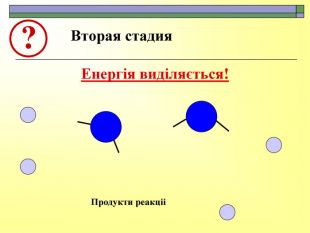
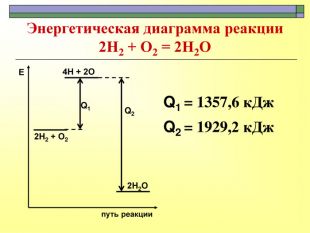
При завершенні курсу неорганічної хімії важливе значення має тема Хімічні реакції. Дана презентація розкриває поняття ендо-, екзотермічні реакції. Підкреплена задачами на обчислення теплового ефекту, показано графік зіміни енергії речовин при хімічних реакціях.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
дякую


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку