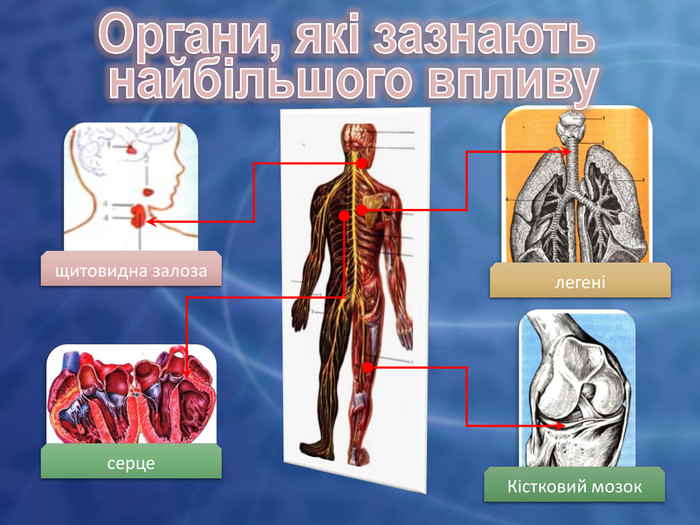
Презентація "Практична робота. Окисно-відновні реакції"
Про матеріал
Розробка містить презентацію як супровід до виконання практичної роботи.В розробці наведено послідовність дій, завдання,є інструктаж з питань безпеки життєдіяльності під час виконання роботи
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
ppt
До підручника
Хімія для загальноосвітніх навчальних закладів з поглибленим вивченням хімії 9 клас (Бутенко А.М.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку