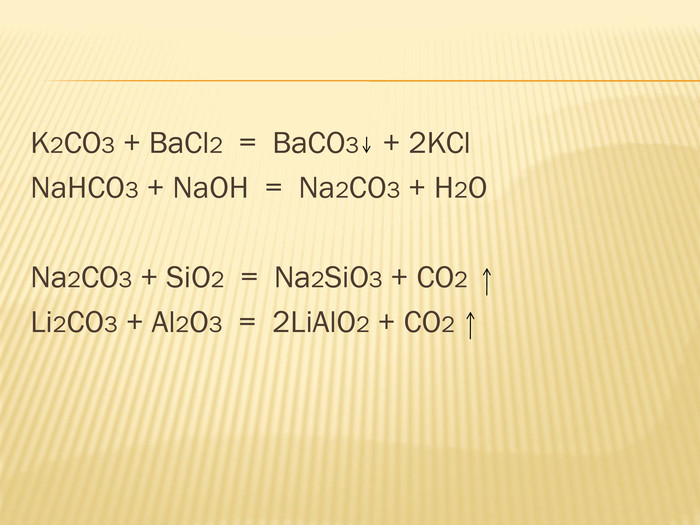Презентація на тему: "Карбонатна кислота. Солі карбонатної кислоти, їх властивості, поширення у природі та застосування".
Про матеріал
Презентація на тему: "Карбонатна кислота. Солі карбонатної кислоти, їх властивості, поширення у природі та застосування".
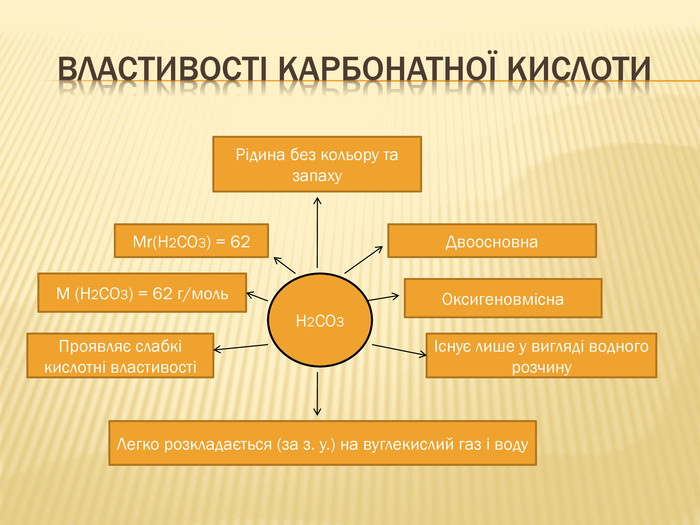
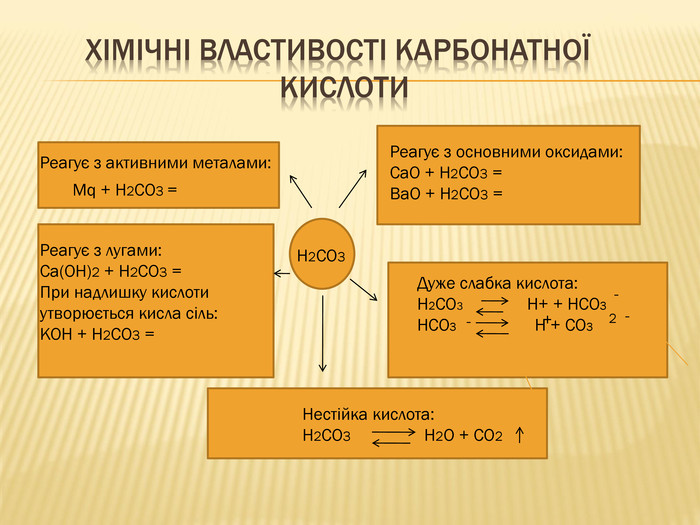
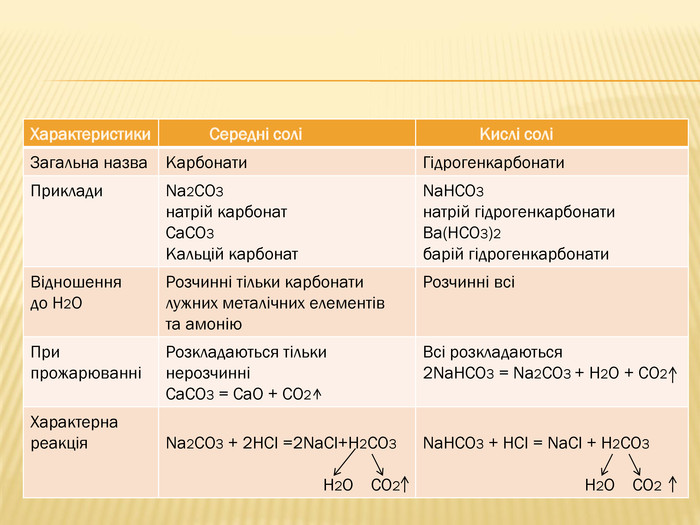
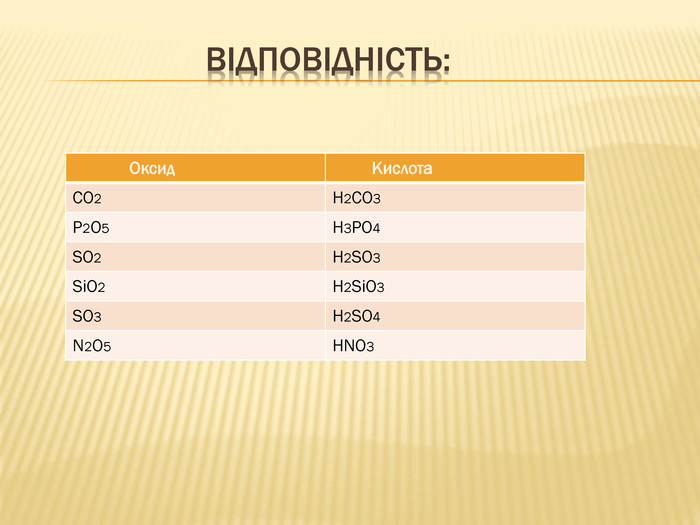
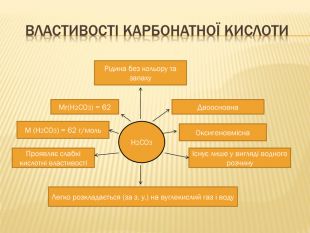
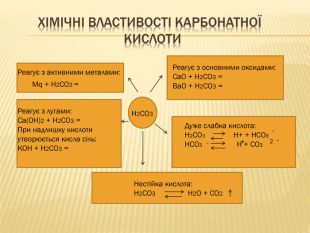
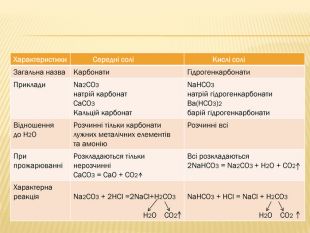
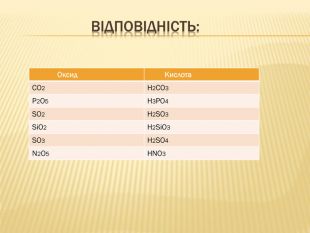
вивчити властивості карбонатної кислоти та її солей;
Мета: ознайомити учнів із поширенням солей карбонатної кислоти у природі;
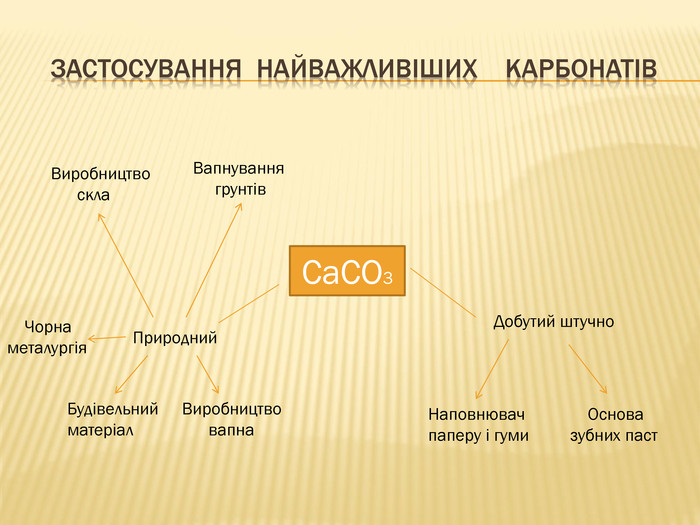
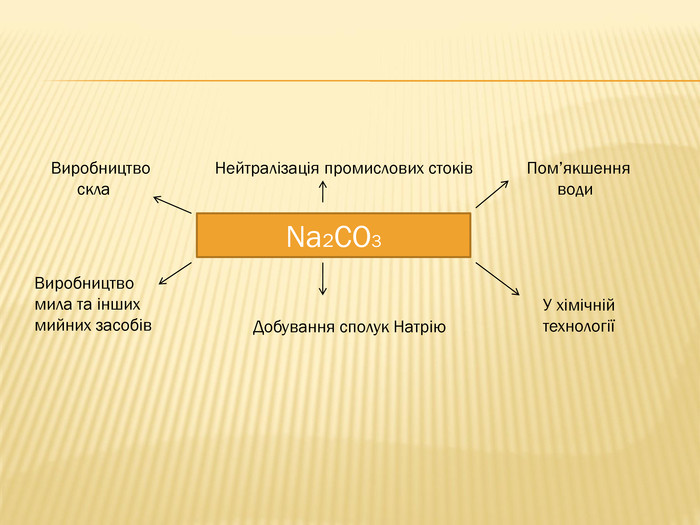
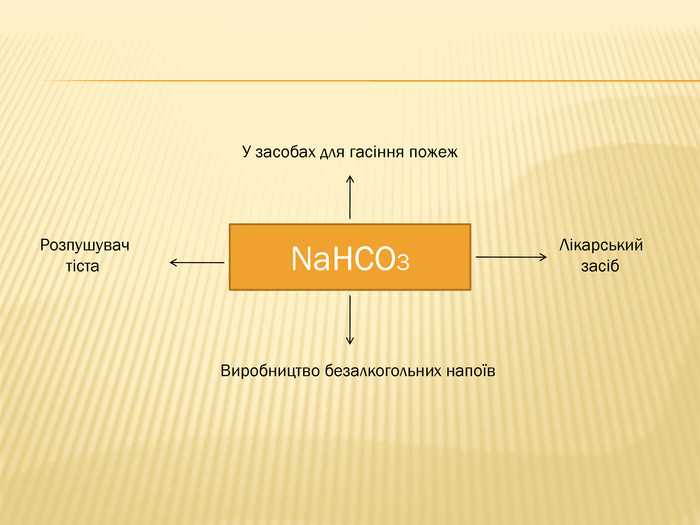
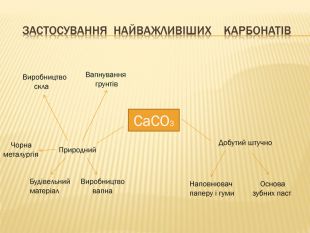
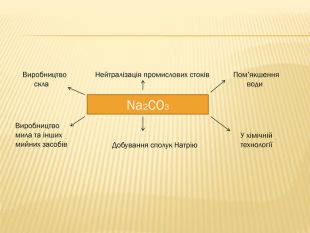
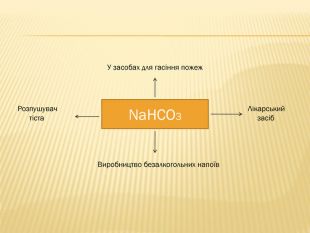
розкрити значення застосування найважливіших карбонатів;
удосконалювати вміння писати рівняння хімічних реакцій та проводити
експерименти. Стимулювати пізнавальну активність учнів, розвивати їх
творчі здібності, інтерес до вивчення хімії; вчити застосовувати знання
на практиці та здобувати їх самостійно; виховувати свідоме
ставлення до використання речовин у побуті.
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку