Презентація на тему: "Ковалентний зв'язок, його утворення"
Про матеріал
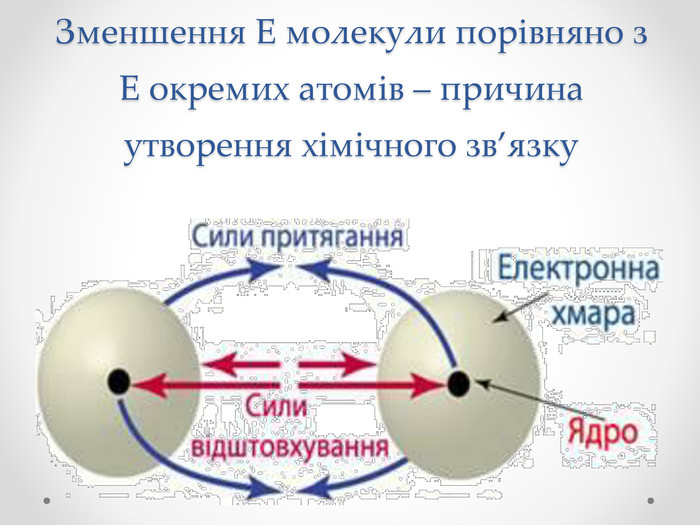
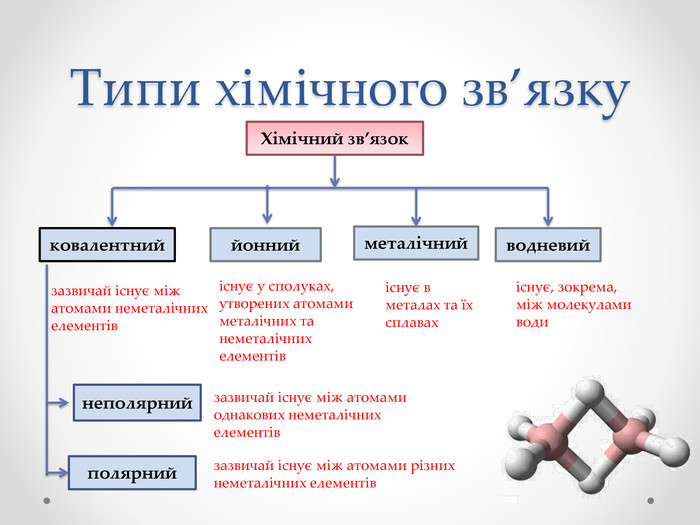
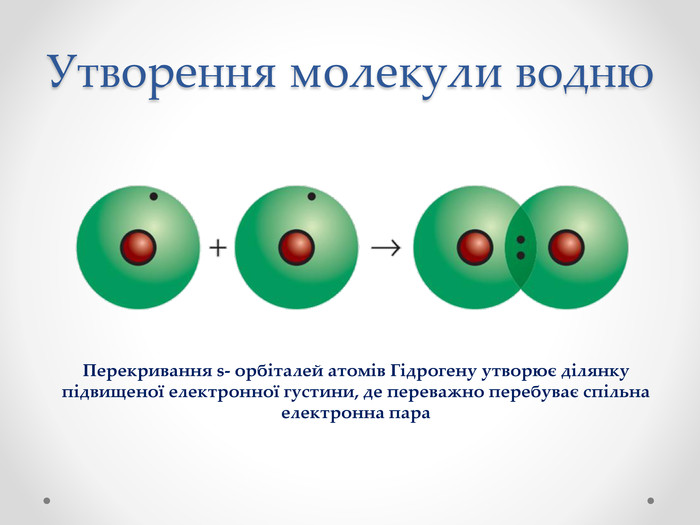
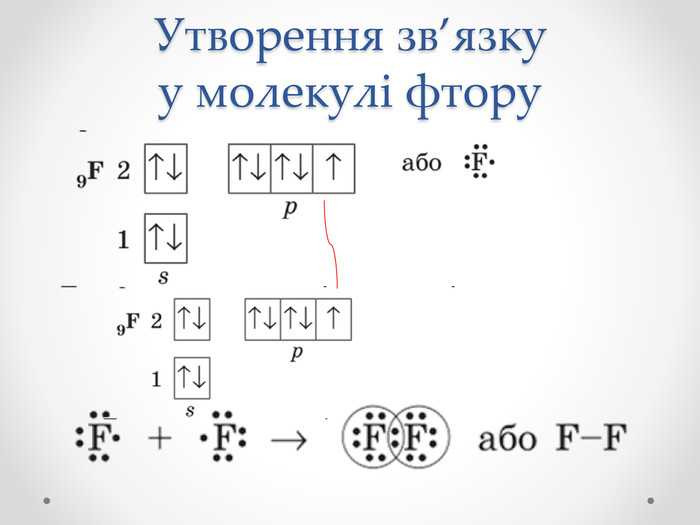
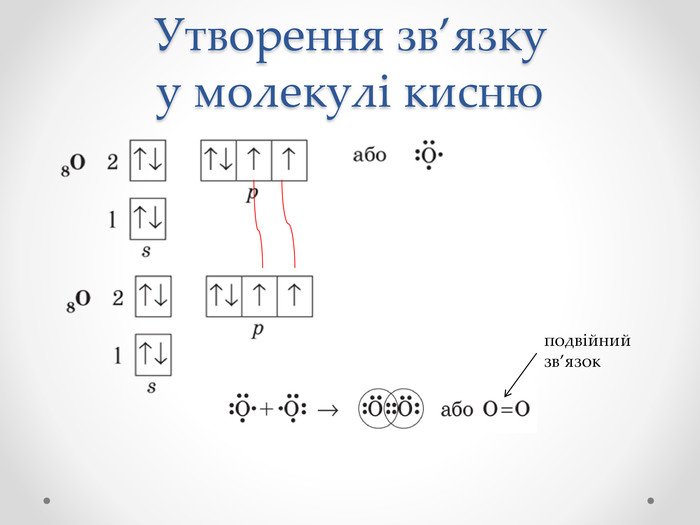
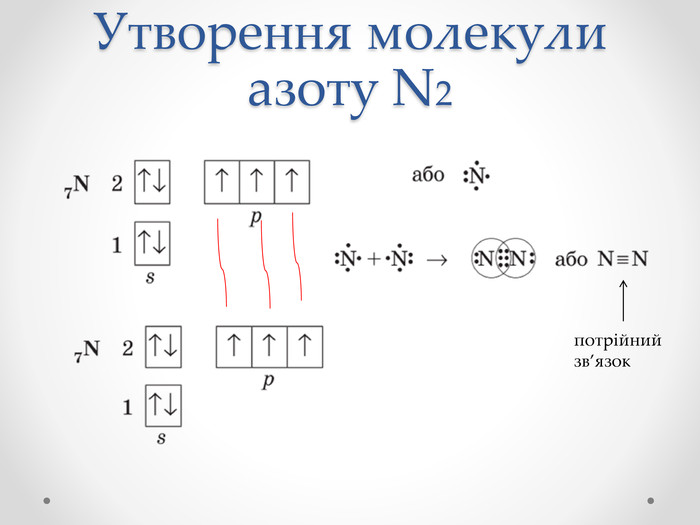
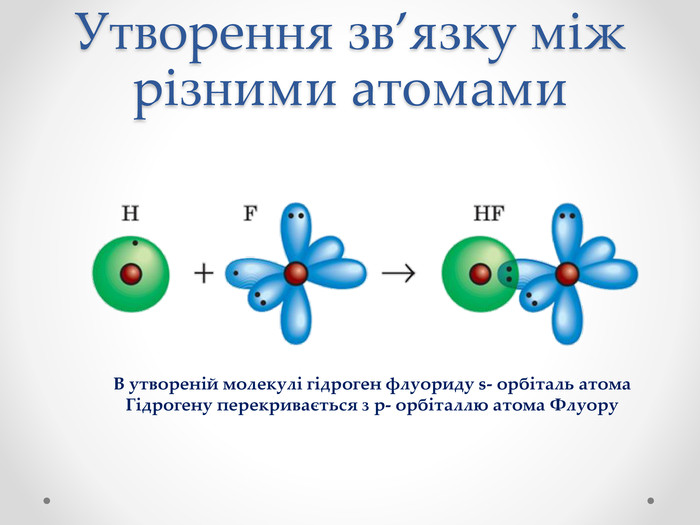
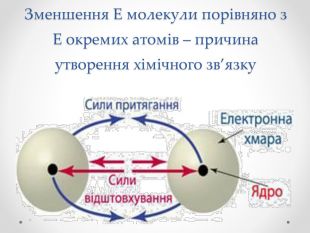
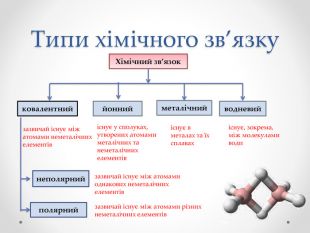
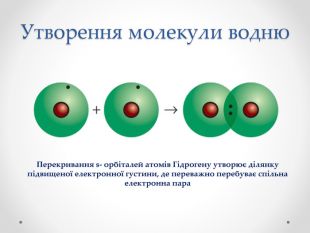
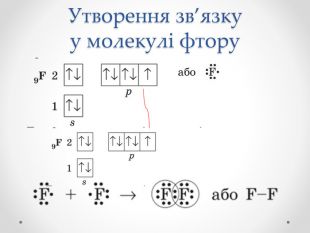
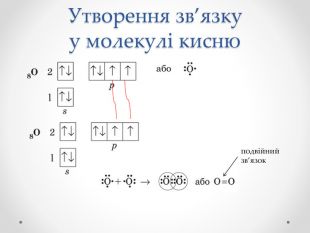
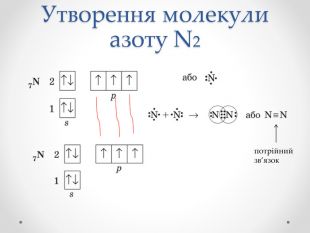
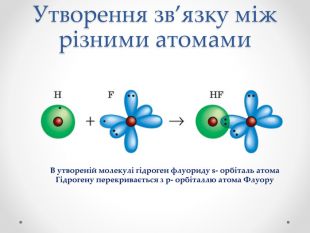
Презентація з хімії для учнів 8 класу на тему "Ковалентний зв'язок, його утворення", містить інформацію про хімічний зв'язок, його типи та механізм утворення ковалентного зв'язку. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку

















-

Потапова Галина Іванівна
05.11.2024 в 19:01
дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Міщенко Галина Миколаївна
10.09.2023 в 17:03
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Крамар Світлана
13.11.2022 в 22:39
лаконічно і точно
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
4.0
-

Воронівська Наталья Гуріївна
13.11.2022 в 18:53
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Kyrman Yora
06.11.2022 в 16:02
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Підкалюк Любов Петрівна
01.11.2022 в 21:28
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Смакоуз Тамара Василівна
10.10.2022 в 19:13
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Кузнєцова Тетяна Анатоліївна
09.05.2022 в 08:05
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Дробот Олена Геннадіївна
03.11.2021 в 16:36
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 6 відгуків