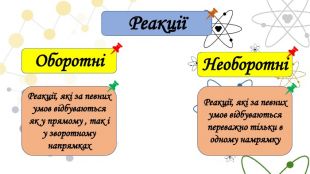
Презентація на тему: "Необоротні і оборотні хімічні процеси. Хімічна рівновага. Принцип Ле Шательє"


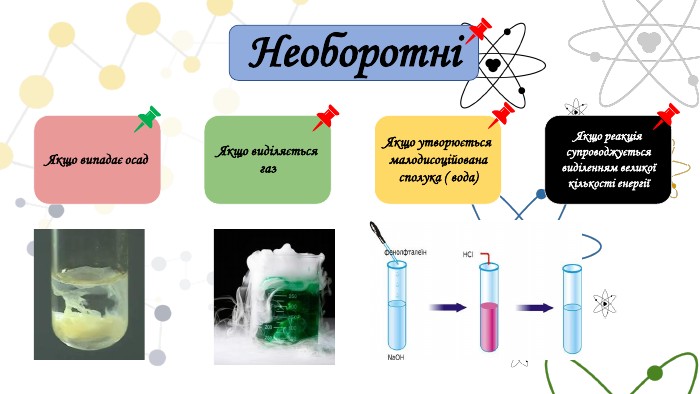











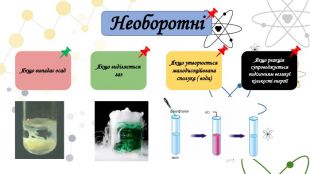
Установіть відповідність між явищем, що свідчить про перебіг хімічної реакції та її реагентами{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}Явище Реагенти 1 Випадання осаду А Натрій хлорид і калій сульфат2 Виділення газу Б Натрій сульфат і барій хлорид3 Утворення малодисоційованої сполуки. В Ортофосфатна кислота і натрій гідроксид Г Калій карбонат і хлоридна кислота
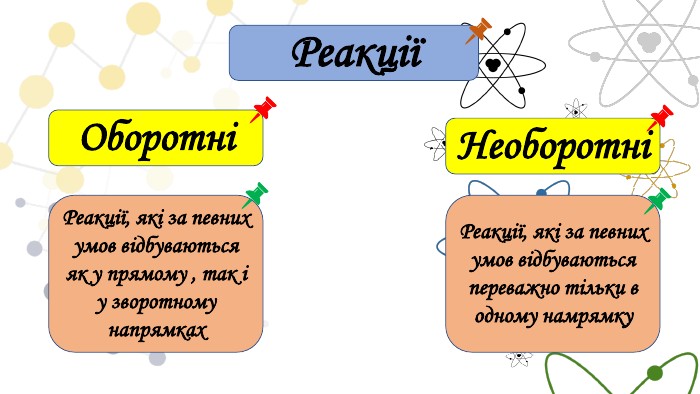
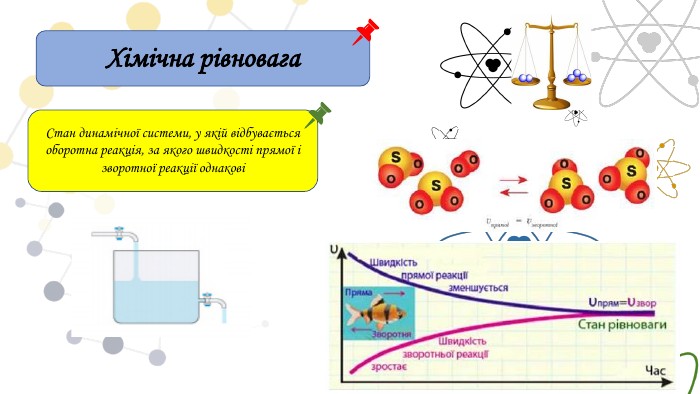
Оборотні реакції в природіПід час грози температура в зоні електричного розряду становить 2000 °С, унаслідок чого азот і кисень, що містяться в повітрі, взаємодіють між собою. Утворюється нітроген(ІІ) оксид. Однак продукт цієї реакції є нестійкою речовиною й легко розкладається на реагенти.
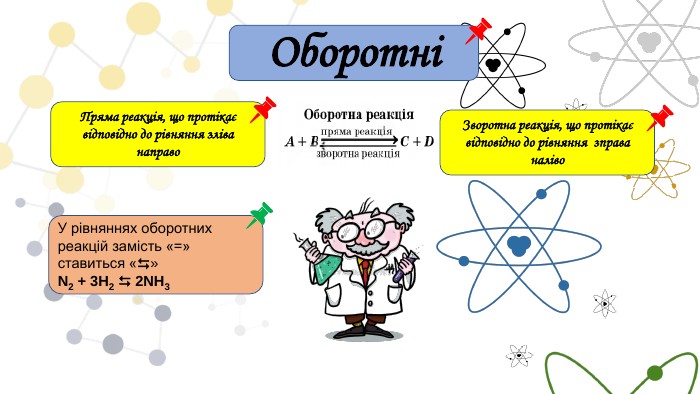
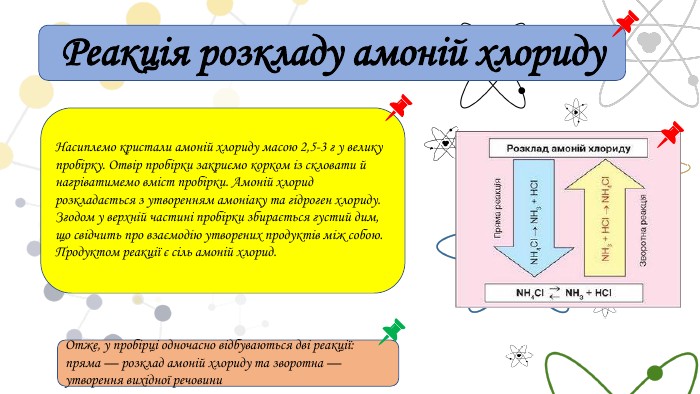
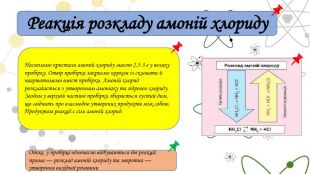
Реакція розкладу амоній хлориду. Насиплемо кристали амоній хлориду масою 2,5-3 г у велику пробірку. Отвір пробірки закриємо корком із скловати й нагріватимемо вміст пробірки. Амоній хлорид розкладається з утворенням амоніаку та гідроген хлориду. Згодом у верхній частині пробірки збирається густий дим, що свідчить про взаємодію утворених продуктів між собою. Продуктом реакції є сіль амоній хлорид. Отже, у пробірці одночасно відбуваються дві реакції: пряма — розклад амоній хлориду та зворотна — утворення вихідної речовини
Історія. Поняття оборотної реакції уведене у 1803 році Клодом Бертолле, після того як він спостерігав як на краю солоного озера у Єгипті утворюються кристали карбонату натрію. До того часу в хімії панувала думка, що хімічні реакції йдуть лише в одному напрямку. Бертолле припустив, що надлишок натрій хлориду в озері повернув реакцію, що він знав з лабораторії у зворотному напрямку, тобто напрямку утворення карбонату натрію. До цього часу він знав іншу, оборотню до цієї, реакцію із своєї лабораторії:
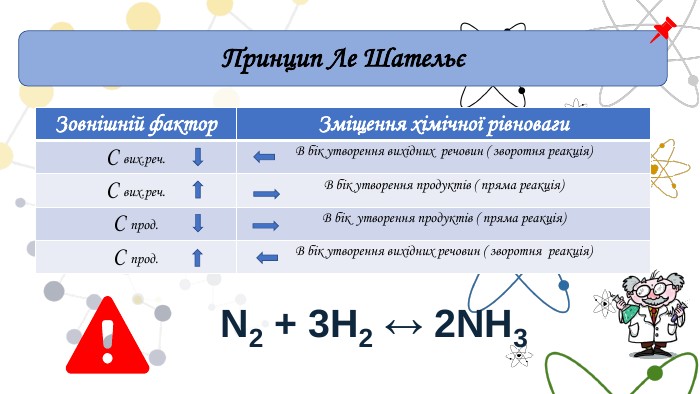
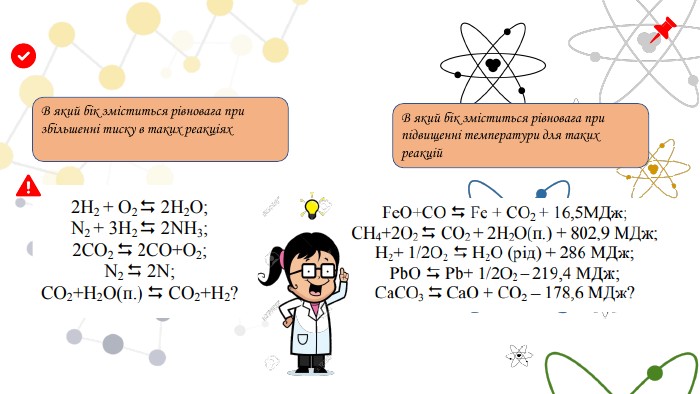
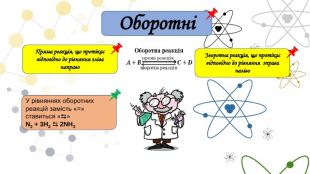
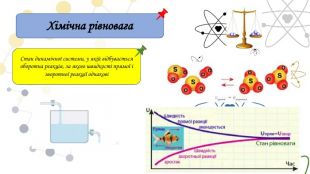
Принцип Ле Шательє{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}Зовнішній фактор Зміщення хімічної рівноваги. С вих.реч. В бік утворення вихідних речовин ( зворотня реакція) С вих.реч. В бік утворення продуктів ( пряма реакція) С прод. В бік утворення продуктів ( пряма реакція) С прод. В бік утворення вихідних речовин ( зворотня реакція) N2 + 3 H2 ↔ 2 NH3
Принцип Ле Шательє{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}Зовнішній фактор Зміщення хімічної рівноваги. T В бік ендотермічної реакції ( -Q , +∆ H)T В бік екзотермічної реакції (+ Q, - ∆ H) P , V В бік утворення менших об’ємів ( меншого числа газоподібних часток) P , V В бік утворення більших об’ємів ( більшого числа газоподібних часток)N2 + 3 H2 ↔ 2 NH3+Q
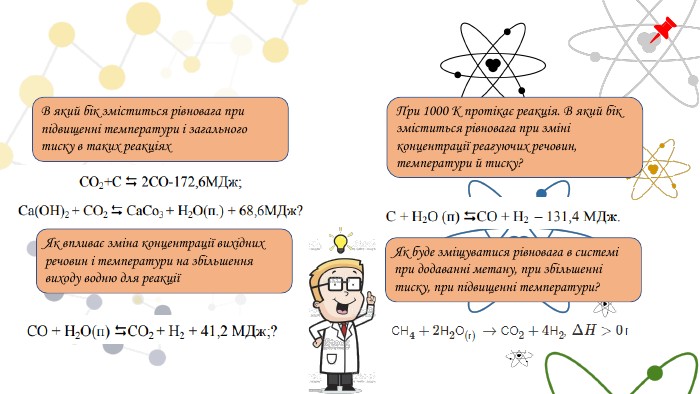
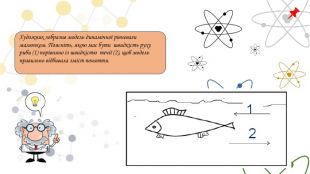
В який бік зміститься рівновага при підвищенні температури і загального тиску в таких реакціях. Як впливає зміна концентрації вихідних речовин і температури на збільшення виходу водню для реакціїПри 1000 К протікає реакція. В який бік зміститься рівновага при зміні концентрації реагуючих речовин, температури й тиску?Як буде зміщуватися рівновага в системі при додаванні метану, при збільшенні тиску, при підвищенні температури?
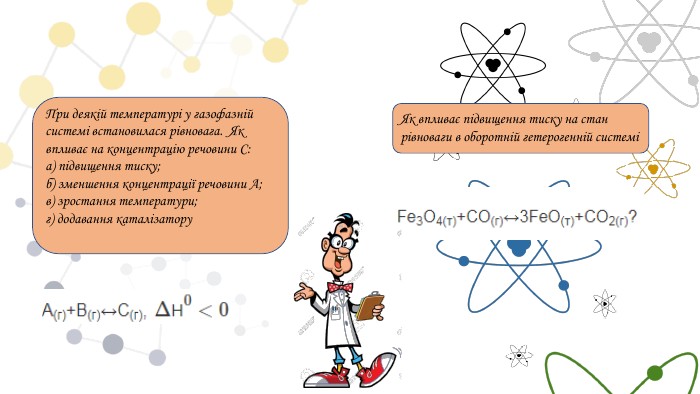
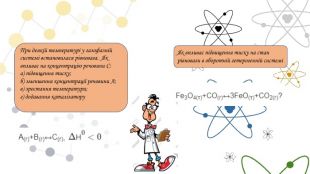
При деякій температурі у газофазній системі встановилася рівновага. Як впливає на концентрацію речовини С:а) підвищення тиску;б) зменшення концентрації речовини А;в) зростання температури;г) додавання каталізатору. Як впливає підвищення тиску на стан рівноваги в оборотній гетерогенній системі
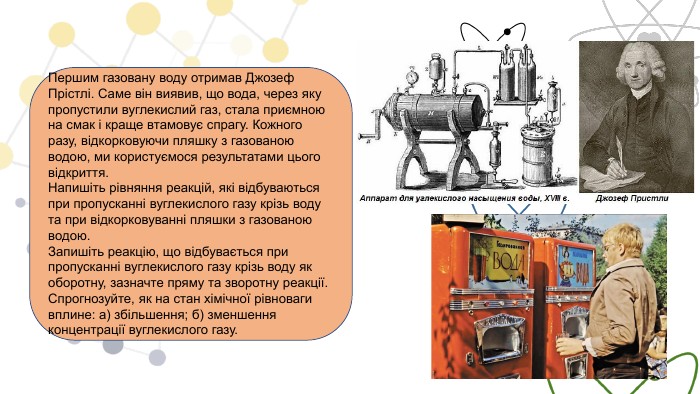
Першим газовану воду отримав Джозеф Прістлі. Саме він виявив, що вода, через яку пропустили вуглекислий газ, стала приємною на смак і краще втамовує спрагу. Кожного разу, відкорковуючи пляшку з газованою водою, ми користуємося результатами цього відкриття. Напишіть рівняння реакцій, які відбуваються при пропусканні вуглекислого газу крізь воду та при відкорковуванні пляшки з газованою водою. Запишіть реакцію, що відбувається при пропусканні вуглекислого газу крізь воду як оборотну, зазначте пряму та зворотну реакції. Спрогнозуйте, як на стан хімічної рівноваги вплине: а) збільшення; б) зменшення концентрації вуглекислого газу.
Як відомо, чадний газ є небезпечним забруднювачем атмосфери, також це отрута, яка утворюється під час неповного згоряння вугілля в печі. Утворення карбон (ІІ) оксиду відбувається у тому числі, в результаті ендотермічної реакції вугілля з вуглекислим газом. С(тв) + СО2 (г.)↔2 СО (г) ; ∆Н=173к. Дж. Запропонуйте спосіб зміщення рівноваги цієї реакції вліво – у бік відносно безпечних продуктів
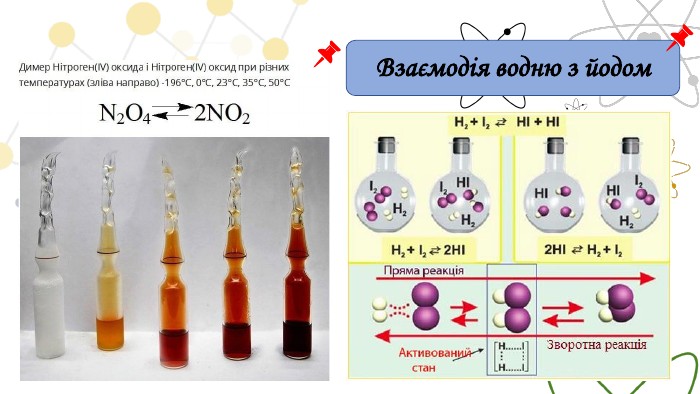
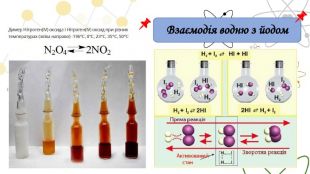
Нітроген (ІV) оксид є шкідливим побічним продуктом металургійних та хімічних підприємств, і часто влітку можна побачити, як із труб валить важкий бурий дим, який називають «лисячий хвіст». Але взимку за низьких температур «лисячі хвости» щезають. Справа в тому, що за низьких температур нітроген (ІV) оксид димеризується N2 O4 – безбарвна рідина, тому колір «лисячих хвостів залежить від співвідношення мономеру та димеру в суміші. Користуючись принципом Ле Шательє, визначте: Екзотермічною чи ендотермічною є реакція утворення димеру: Як впливає тиск на перебіг прямої реакції2 NO2↔N2 O4
Інтернет – ресурси:https://uk.wikipedia.org/wiki/%D0%9 E%D0%B1%D0%BE%D1%80%D0%BE%D1%82%D0%BD%D1%96_%D1%80%D0%B5%D0%B0%D0%BA%D1%86%D1%96%D1%97https://mozok.click/2423-oborotn-y-neoborotn-reakcyi.htmlhttps://techemy.com/%D0%BE%D0%B1%D0%BE%D1%80%D0%BE%D1%82%D0%BD%D1%96-%D1%80%D0%B5%D0%B0%D0%BA%D1%86%D1%96%D1%97/https://disted.edu.vn.ua/courses/learn/10434https://elearning.sumdu.edu.ua/free_content/lectured:c025ee0d1cacd40c9b6db4f8ec2bad8c5184bb2c/latest/471731/index.html. Список використаних джерел


про публікацію авторської розробки
Додати розробку


















-

Фертак Наталя Володимирівна
27.10.2025 в 21:23
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Бойченко Наталія Костянтинівна
21.10.2025 в 06:46
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Сухіна Наталія
13.03.2025 в 11:16
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Овчарова Алевтина Вікторівна
13.05.2024 в 13:35
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Herasymova Olena
30.10.2023 в 11:30
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Дзевенко Марія Віталіївна
12.11.2022 в 15:48
Чудова презентація!
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Товстолес Лариса
20.10.2022 в 11:12
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Кікоть Людмила Іванівна
26.07.2022 в 19:08
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 5 відгуків