Презентація "Поняття про гальванічний елемент як хімічне джерело електричного струму"
















![Маховський Микола Володимирович вчитель хімії Березанського НВКНікель-метал-гідридний акумулятор (англ. Nickel-metal hydride battery, скорочено Ni. MH) — електричний акумулятор з категорії вторинних батарей у якому позитивним електродом є оксидно-нікелевий електрод, а негативним — електрод зі сплавів нікелю з металами рідкоземельної групи, здатних до адсорбції водню і десорбції його при зміні полярності. На відміну від нікель-кадмієвого акумулятора, в якому негативним електродом є кадмієвий електрод, нікель-метал-гідридні акумулятори мають вищі енергетичні характеристики, однак мають вужчий температурний діапазон експлуатації і до того ж мають трохи більший саморозряд і більш чутливі до перегріву, що призводить до необхідності вбудовування в батареї елементів захисту. Вартість однієї А/год нікель-метал-гідридних акумуляторів на 30-50% вища, ніж у нікель-кадмієвих.[1] Ni. MH акумулятори можуть мати ємність в 2-3 рази більшу від Ni. Cd, а їх густина енергії наближується до густини енергії літій-іонних акумуляторів. Напруга елемента: максимальна — 1,4 В (повний заряд); мінімальна −0,9 В (повний розряд). Цей тип батареї особливо популярний для використання в цифрових камерах, тому що вони можуть витримувати високі навантаження і при цьому забезпечити гарну, на відміну від звичайних лужних батарей продуктивність Маховський Микола Володимирович вчитель хімії Березанського НВКНікель-метал-гідридний акумулятор (англ. Nickel-metal hydride battery, скорочено Ni. MH) — електричний акумулятор з категорії вторинних батарей у якому позитивним електродом є оксидно-нікелевий електрод, а негативним — електрод зі сплавів нікелю з металами рідкоземельної групи, здатних до адсорбції водню і десорбції його при зміні полярності. На відміну від нікель-кадмієвого акумулятора, в якому негативним електродом є кадмієвий електрод, нікель-метал-гідридні акумулятори мають вищі енергетичні характеристики, однак мають вужчий температурний діапазон експлуатації і до того ж мають трохи більший саморозряд і більш чутливі до перегріву, що призводить до необхідності вбудовування в батареї елементів захисту. Вартість однієї А/год нікель-метал-гідридних акумуляторів на 30-50% вища, ніж у нікель-кадмієвих.[1] Ni. MH акумулятори можуть мати ємність в 2-3 рази більшу від Ni. Cd, а їх густина енергії наближується до густини енергії літій-іонних акумуляторів. Напруга елемента: максимальна — 1,4 В (повний заряд); мінімальна −0,9 В (повний розряд). Цей тип батареї особливо популярний для використання в цифрових камерах, тому що вони можуть витримувати високі навантаження і при цьому забезпечити гарну, на відміну від звичайних лужних батарей продуктивність](/uploads/files/2906931/293562/321172_images/19.jpg)
![Маховський Микола Володимирович вчитель хімії Березанського НВКЛітій-іонний акумулятор (англ. Lithium-ion battery, скорочено Li-ion) — один з двох основних типів літієвих електричних акумуляторів з категорії вторинних електричних батарей, який різниться з літій-полімерним акумулятором лише типом електроліту, що використовується при їх виготовленні.[1] Широко розповсюджений в побутовій електроніці. Назву літій-іонні акумулятори одержали через те, що електричний струм в зовнішньому колі з'являється через перенос літієвих іонів від анода до катода на основі різних сполук. Хімічний склад, експлуатаційні характеристики, вартість та безпечність акумуляторів відрізняються залежно від типу літій-іонних акумуляторів. Найбільш поширеним у переносній електроніці є акумулятори з катодом на оксиді кобальта (Li. Co. O2), що мають високу енергетичну густину, але мають недолік з точки зору безпеки експлуатації, особливо при пошкодженні. Літій-ферум-фосфатні (відомі як літій-залізо-фосфатні, Li. Fe. PO4), літій-манган-оксидні (Li. Mn2 O4, Li2 Mn. O3 або літій-манганові акумулятори LMO) та літій-нікель-манган-кобальт-оксидні (Li. Ni. Mn. Co. O2 чи NMC) акумулятори, що теж названі за типом катоду, пропонують нижчі рівні енергетичної густини, але мають довший життєвий цикл та безпечніші з хімічної точки зору. Такі акумулятори широко застосовуються в електроінструментах, медичному обладнанні та ін. NMC, зокрема, є лідером за використанням у автомобільній промисловості. Літій-нікель-кобальт-алюміній-оксидні (Li. Ni. Co. Al. O2 або NCA), що теж названий за катодом, та літій-титанатові (Li4 Ti4 O12 чи LTO) акумулятори (назва останнього за анодом), спеціально розроблені для певних нішових ролей. Нові літій-сульфурні акумулятори обіцяють найвище відношення експлуатаційних характеристик до ваги Маховський Микола Володимирович вчитель хімії Березанського НВКЛітій-іонний акумулятор (англ. Lithium-ion battery, скорочено Li-ion) — один з двох основних типів літієвих електричних акумуляторів з категорії вторинних електричних батарей, який різниться з літій-полімерним акумулятором лише типом електроліту, що використовується при їх виготовленні.[1] Широко розповсюджений в побутовій електроніці. Назву літій-іонні акумулятори одержали через те, що електричний струм в зовнішньому колі з'являється через перенос літієвих іонів від анода до катода на основі різних сполук. Хімічний склад, експлуатаційні характеристики, вартість та безпечність акумуляторів відрізняються залежно від типу літій-іонних акумуляторів. Найбільш поширеним у переносній електроніці є акумулятори з катодом на оксиді кобальта (Li. Co. O2), що мають високу енергетичну густину, але мають недолік з точки зору безпеки експлуатації, особливо при пошкодженні. Літій-ферум-фосфатні (відомі як літій-залізо-фосфатні, Li. Fe. PO4), літій-манган-оксидні (Li. Mn2 O4, Li2 Mn. O3 або літій-манганові акумулятори LMO) та літій-нікель-манган-кобальт-оксидні (Li. Ni. Mn. Co. O2 чи NMC) акумулятори, що теж названі за типом катоду, пропонують нижчі рівні енергетичної густини, але мають довший життєвий цикл та безпечніші з хімічної точки зору. Такі акумулятори широко застосовуються в електроінструментах, медичному обладнанні та ін. NMC, зокрема, є лідером за використанням у автомобільній промисловості. Літій-нікель-кобальт-алюміній-оксидні (Li. Ni. Co. Al. O2 або NCA), що теж названий за катодом, та літій-титанатові (Li4 Ti4 O12 чи LTO) акумулятори (назва останнього за анодом), спеціально розроблені для певних нішових ролей. Нові літій-сульфурні акумулятори обіцяють найвище відношення експлуатаційних характеристик до ваги](/uploads/files/2906931/293562/321172_images/20.jpg)

![Маховський Микола Володимирович вчитель хімії Березанського НВКЛі́тій-поліме́рний акумуля́тор (англ. lithium-ion polymer batteries, lithium polymer batteries, скор. Li-Pol, Li-poly, Li. Po, LIP) — один із запропонованих типів літієвих електричних акумуляторів із категорії вторинних електричних батарей, який відрізняється від звичайного літій-іонного акумулятора лише типом електроліту, що використовується при їх виготовленні. У випадку з Li-ion — це гелеподібний або рідкий електроліт, у випадку з Li-Pol — спеціальний щільний[1] полімер, насичений розчином літію. На сьогодні існує непорозуміння, викликане маркетинговим підходом. Представлені на ринку літій-полімерні акумулятори насправді є звичайними літій-іонними акумуляторами у пластиковому корпусі. Технічно вони відрізняються лише зовнішньою формою та оболонкою (так званий pouch-bag формат). Реальні літій-полімерні акумулятори через свої надзвичайно низькі характеристики не були представлені для продажу на ринку, хоча через їх перспективні переваги роботи по їх дослідженню та розробці проводяться і надалі Маховський Микола Володимирович вчитель хімії Березанського НВКЛі́тій-поліме́рний акумуля́тор (англ. lithium-ion polymer batteries, lithium polymer batteries, скор. Li-Pol, Li-poly, Li. Po, LIP) — один із запропонованих типів літієвих електричних акумуляторів із категорії вторинних електричних батарей, який відрізняється від звичайного літій-іонного акумулятора лише типом електроліту, що використовується при їх виготовленні. У випадку з Li-ion — це гелеподібний або рідкий електроліт, у випадку з Li-Pol — спеціальний щільний[1] полімер, насичений розчином літію. На сьогодні існує непорозуміння, викликане маркетинговим підходом. Представлені на ринку літій-полімерні акумулятори насправді є звичайними літій-іонними акумуляторами у пластиковому корпусі. Технічно вони відрізняються лише зовнішньою формою та оболонкою (так званий pouch-bag формат). Реальні літій-полімерні акумулятори через свої надзвичайно низькі характеристики не були представлені для продажу на ринку, хоча через їх перспективні переваги роботи по їх дослідженню та розробці проводяться і надалі](/uploads/files/2906931/293562/321172_images/22.jpg)
Маховський Микола Володимирович вчитель хімії Березанського НВКМета уроку- Систематизувати та узагальнити знання учнів про гальванічний елемент як джерело електричного струму;- З’ясувати як утворюється електричний струм на основі окисно-відновних реакцій, навчитися пояснювати процеси, що відбуваються на електродах у гальванічному елементі;- Ознайомитись із різноманітністю приладів, які використовуються як джерело електричного струму; - Виявити необхідність утилізації використаних гальванічних елементів та шкідливий вплив продуктів їх розкладу на довкілля. Міжпредметні звязки. Фізика, біологія та екологія, історія, географія
Актуалізація опорних знань1. Укажіть правильну відповідь щодо кількості йонів у водному розчині ферум(ІІ) сульфату і поясніть ваш вибір:а) катіонів Fe2+ менше, ніж сульфатіонів;б) сульфатіонів менше, ніж катіонів Fe2+в) йонів Fe2+ та SO4 2– — однакова кількість;г) йонів H+ та OH– — однакова кількість.style.colorstyle.colorstyle.colorstyle.colorstyle.color
2. У наведеному переліку виберіть формули солей, що зазнаютьгідролізу: Ba. Cl2,KNO3,HCOONH4 Al2(SO4)3,3. Як можна класифікувати гідроліз солі: Як реакція обміну між сіллю і водою. Як реакція заміщення між сіллю і воднем. Як реакція сполучення води і соліЯк реакція розкладання соліstyle.colorstyle.colorstyle.colorfillcolorfill.typefill.onstyle.colorstyle.colorstyle.colorstyle.colorstyle.color
З історії відкриття Наприкінці XVIII ст. італійський фізик Алессандро Вольта (Рис. 1) винайшов оригінальний пристрій, що виробляв електричний струм. Це був немов товстий «бутерброд» iз металічних пластин (міді і цинку) i тканини, яка заздалегідь була просякнута розчином сульфатної кислоти. До першої та останньої пластинок припаювали дротинки. Якщо ix занурювали у воду, то на поверхні кожної дротинки починалося виділення газу. Це відбувався електроліз води. Отже, крізь воду проходив електричний струм. Винайдене джерело струму було названо гальванічним елементом на честь Луїджі Гальвані (1737–1798) – італійського лікаря, анатома і фізіолога, який є одним із засновників електрофізіології. Перший гальванічний елемент був незручним у користуванні i мав короткий час дії: поява на електроді бульбашок газу ускладнювала рух йонів біля електроду. У 1836 році англійський хімік Джон Фредерик Даніель та незалежно від нього німецький і російський фізик-винахідник Б. С. Якобі, запропонували інший елемент, що виробляв електричний струм протягом значно довшого часу. Маховський Микола Володимирович вчитель хімії Березанського НВКГальванічний елемент Даніеля-Якобі складається з двох посудин (Рис. 2). В одній міститься розчин цинк сульфату, у який занурено пластинку з цинку, в іншій – купрум(ІІ) сульфату у який занурено пластинку з міді. Розчини з’єднано трубкою (сольовим містком), що заповнена розчином електроліту, йони якого ʜе взаємодіють з іншими йонами в гальванічному елементі, наприклад натрій нітрату. У такий спосіб забезпечується електричний контакт між посудинами. Для того щоб розчин не виливався, кінці трубки закривають скловатою чи гелем, просоченим електролітом.
Принцип роботи гальванічного елемента. Вам відомі реакції, які називають окисно-відновними. Під час їх перебігу одні частинки (атоми, молекули, йони) втрачають електрони, а інші їх приєднують. До окисновідновних реакцій належать, зокрема, реакції металів із солями. Якщо занурити цинкову пластинку в розчин купрум(ІІ) сульфату, почнеться реакція. Zn + Cu. SO4 = Cu + Zn. SO4. Цинк поступово «розчинятиметься», а мідь осаджуватиметься на пластинці, а можливо, й осипатиметься з неї на дно посудини. Про такі реакції нерідко кажуть, що більш активний метал «витісняє» із солі менш активний. Йонномолекулярне рівняння цієї реакції: Zn + Cu2+ = Cu + Zn2+. Атоми Цинку виконують роль відновника, віддають електрони й перетворюються на катіони Zn – 2e– → Zn2+ Йони Купруму - окисник; вони приєднують електрони й перетворюються на атоми Cu2+ + 2e–→Cu. Маховський Микола Володимирович вчитель хімії Березанського НВК
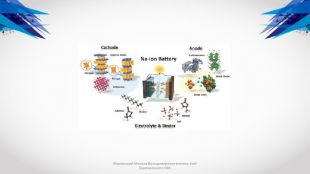
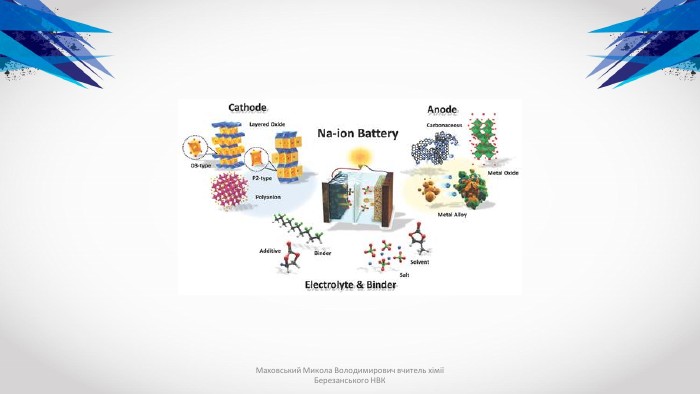
Типи акумуляторів. До найбільш вживаних в мобільних телефонах і радіозв'язку ставляться такі типи акумуляторів:нікелево-кадмієві (Ni-Cd)нікелево-металогідридні (Ni-MH)літієво-іонні (Li-Ion)герметичні свинцево-кислотні (SLA)літієво-полімерні (Li-polymer) Різні типи акумуляторів мають не тільки різну вартість, але і відрізняються за основними параметрами: кількістю циклів перезарядки, максимального терміну зберігання, що віддається ємності, розмірами, температурному діапазону роботи, можливостям прискореної зарядки і т. д. Акумулятори виконуються як у вигляді одного елемента, так і декількох, послідовно включених і оформлених в одному корпусі елементів - батареї. Деякі моделі акумуляторів включають в себе електронні елементи управління, що забезпечують контроль режиму заряду і захист акумулятора від неправильної експлуатації. Як правило, кожен виробник використовує оригінальну технологію виробництва, і, відповідно, свої власні розробки по конструкції тих чи інших моделей. Тим не менше можна виділити кілька загальних підходів до конструкції різних типів акумуляторів. Маховський Микола Володимирович вчитель хімії Березанського НВК
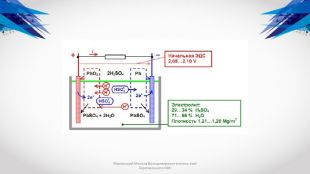
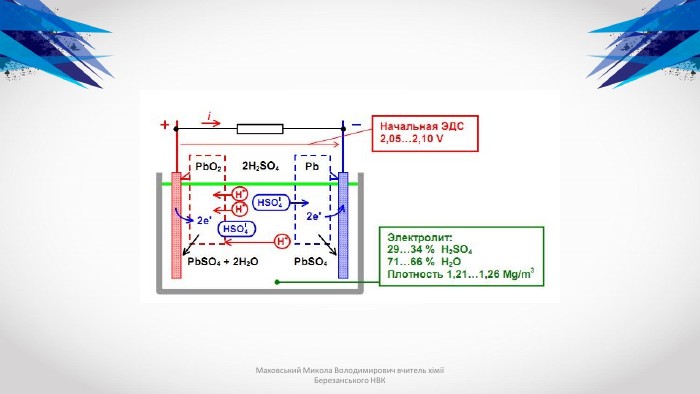
Маховський Микола Володимирович вчитель хімії Березанського НВК Під впливом напруги джерела постійного струму, в ланцюг якого включений акумулятор, у зовнішній ланцюга встановлюється спрямований рух електронів до негативного висновку батареї. Двовалентні іони свинцю відновлюються електронами що надходять, перетворюючи активну масу негативних пластин в металевий губчастий свинець, з утворенням сірчаної кислоти: Pb. SO4+ 2e = Pb + SO42- У позитивного електрода під дією зарядного струму двовалентні іони свинцю Pb2+ віддають два електрона, окислюючись до чотиривалентного іона Pb4+ Останні, з'єднуючись з двома іонами кисню, утворюють оксид свинцю Pb. O2, який виділяється на електроді. Іони SO42- і H+ утворюють сульфатну кислоту, в результаті чого зростає щільність електроліту. Сумарна реакція має вигляд: Pb. SO4+ 2 H2 O = Pb. O2+ Pb + 2 H2 SO4 Коли процеси перетворення речовин в активних масах позитивного і негативного електродів закінчені, щільність електроліту перестає змінюватися, що є ознакою кінця заряду акумулятора.
Використання гальванічних елементів. Використання акумуляторів в техніці Акумулятори широко застосовуються для авто та інших видів техніки. Особливо популярні свинцеві пластини на накопичувачах, так як вони покращують енергоподачу і служать досить довго. В автомашинах пріоритетним є акумулятори з кислотним електролітом. Також в техніці використовуються гідравлічні або пневматичні накопичувачі. На промислових підприємствах встановлюються теплові акумулятори для вирівнювання силового і теплового навантаження у техніці. Завдяки їм їздять тролейбуси, залізничні вагони, електрокари. Акумуляторні батареї оснащують штабелери і навантажувачі. Крім того, їх часто встановлюють на підйомниках і електровозах, які характеризуються високим запасом механічної міцності і тривалим терміном служби. Вони використовуються для запуску дизеля, старту літакових двигунів і заряду електронних приладів. Адже вони накопичують достатню кількість енергії, щоб «оживити» величезні машини зі сталі. Маховський Микола Володимирович вчитель хімії Березанського НВК
Маховський Микола Володимирович вчитель хімії Березанського НВКВикористання акумуляторів в побуті У побуті акумулятори застосовуються не рідше і теж здебільшого в техніці, якою користується людина. Накопичувачі вбудовані в портативні пристрої: нетбуки, ноутбуки, смартфони і мобільні телефони. Також вони використовуються для аварійного освітлення приміщення в тому випадку, коли раптово відключається світло. Як бачите, акумулятори є невід’ємною частиною нашого життя. Вони всюди, під капотом Вашої машини, на Вашому робочому місці і вдома.
Маховський Микола Володимирович вчитель хімії Березанського НВК Гальванічний елемент – хімічне джерело електричного струму, яке засновано на взаємодії двох металів і (або) їх оксидів в електроліті, що призводить до виникнення в замкнутому ланцюзі електричного струму. Робота гальванічного елемента характеризується його електрорушійною силою (ЕРС), яку можна визначити за різницею потенціалів катоду і аноду. У гальванічному елементі частина внутрішньої енергії речовин перетворюється на електричну. ВИСНОВКИr
Маховський Микола Володимирович вчитель хімії Березанського НВКАнодом є металічний кадмій Cd (у вигляді порошку), електролітом — гідроксид калію KOH з додаванням гідроксиду літію Li. OH (для утворення нікелатів літію і збільшення ємності на 21-25 %), катод — гідрат окису нікелю Ni. OOH з графітовим порошком (близько 5-8 %). ЕРС нікель-кадмієвого акумулятора близько 1,45 В, питома енергія близько 45—65 Вт·год/кг. В залежності від конструкції, режиму роботи (тривалі чи короткі розряди), і чистоти матеріалів, що застосовуються, термін служби становить від 100 до 3500 циклів заряд-розряд. Сучасні (ламельні) промислові нікель-кадмієві батареї можуть служити до 20-25 років. Нікель-кадмієві акумулятори (Ni-Cd) — єдиний тип акумуляторів, який може зберігатися розрядженним — на відміну від нікель-метал-гідридних акумуляторів (Ni-MH), які потрібно зберігати повністю зарядженними, і літій-йонних акумуляторів (Li-ion), які необхідно зберігати при 40%-ому заряді від ємності акумулятора. При зберіганні у розрядженому стані нікель-кадмієві акумулятори не втрачають працездатності протягом тривалого періоду — до 10 років
Маховський Микола Володимирович вчитель хімії Березанського НВКНікель-метал-гідридний акумулятор (англ. Nickel-metal hydride battery, скорочено Ni. MH) — електричний акумулятор з категорії вторинних батарей у якому позитивним електродом є оксидно-нікелевий електрод, а негативним — електрод зі сплавів нікелю з металами рідкоземельної групи, здатних до адсорбції водню і десорбції його при зміні полярності. На відміну від нікель-кадмієвого акумулятора, в якому негативним електродом є кадмієвий електрод, нікель-метал-гідридні акумулятори мають вищі енергетичні характеристики, однак мають вужчий температурний діапазон експлуатації і до того ж мають трохи більший саморозряд і більш чутливі до перегріву, що призводить до необхідності вбудовування в батареї елементів захисту. Вартість однієї А/год нікель-метал-гідридних акумуляторів на 30-50% вища, ніж у нікель-кадмієвих.[1] Ni. MH акумулятори можуть мати ємність в 2-3 рази більшу від Ni. Cd, а їх густина енергії наближується до густини енергії літій-іонних акумуляторів. Напруга елемента: максимальна — 1,4 В (повний заряд); мінімальна −0,9 В (повний розряд). Цей тип батареї особливо популярний для використання в цифрових камерах, тому що вони можуть витримувати високі навантаження і при цьому забезпечити гарну, на відміну від звичайних лужних батарей продуктивність
Маховський Микола Володимирович вчитель хімії Березанського НВКЛітій-іонний акумулятор (англ. Lithium-ion battery, скорочено Li-ion) — один з двох основних типів літієвих електричних акумуляторів з категорії вторинних електричних батарей, який різниться з літій-полімерним акумулятором лише типом електроліту, що використовується при їх виготовленні.[1] Широко розповсюджений в побутовій електроніці. Назву літій-іонні акумулятори одержали через те, що електричний струм в зовнішньому колі з'являється через перенос літієвих іонів від анода до катода на основі різних сполук. Хімічний склад, експлуатаційні характеристики, вартість та безпечність акумуляторів відрізняються залежно від типу літій-іонних акумуляторів. Найбільш поширеним у переносній електроніці є акумулятори з катодом на оксиді кобальта (Li. Co. O2), що мають високу енергетичну густину, але мають недолік з точки зору безпеки експлуатації, особливо при пошкодженні. Літій-ферум-фосфатні (відомі як літій-залізо-фосфатні, Li. Fe. PO4), літій-манган-оксидні (Li. Mn2 O4, Li2 Mn. O3 або літій-манганові акумулятори LMO) та літій-нікель-манган-кобальт-оксидні (Li. Ni. Mn. Co. O2 чи NMC) акумулятори, що теж названі за типом катоду, пропонують нижчі рівні енергетичної густини, але мають довший життєвий цикл та безпечніші з хімічної точки зору. Такі акумулятори широко застосовуються в електроінструментах, медичному обладнанні та ін. NMC, зокрема, є лідером за використанням у автомобільній промисловості. Літій-нікель-кобальт-алюміній-оксидні (Li. Ni. Co. Al. O2 або NCA), що теж названий за катодом, та літій-титанатові (Li4 Ti4 O12 чи LTO) акумулятори (назва останнього за анодом), спеціально розроблені для певних нішових ролей. Нові літій-сульфурні акумулятори обіцяють найвище відношення експлуатаційних характеристик до ваги
Маховський Микола Володимирович вчитель хімії Березанського НВКСвинцево-кислотний акумулятор або свинцево-кислотна акумуляторна батарея (англ. Lead-acid battery) — електричний акумулятор з категорії вторинних батарей, принцип роботи якого заснований на електрохімічних реакціях свинцю і діоксиду свинцю в кислому сірчаному середовищі. Автомобільний свинцево-кислотниий акумулятор. Акумулятори отримали широке розповсюдження для живлення електрообладнання транспортних засобів як стартерні автомобільні батареї, для живлення переносної радіо і телефонної апаратури; як тягові батареї (EVB) глибокого заряду-розряду в електричних транспортних засобах; для живлення стаціонарних приладів, ДБЖ. Загалом у пасажирських і комерційних автомобілях використовуються батареї напругою 12 вольт постійного струму, в той час як у вантажівках та автобусах, як правило, — 24 вольт. Ємність акумулятора вимірюється в ампер-годинах (Ah). Свинцево-кислотну батарею було винайдено в 1859 році французьким фізиком Гастоном Планте. Свинцево-кислотний акумулятор є найстарішими типом акумулятора.
Маховський Микола Володимирович вчитель хімії Березанського НВКЛі́тій-поліме́рний акумуля́тор (англ. lithium-ion polymer batteries, lithium polymer batteries, скор. Li-Pol, Li-poly, Li. Po, LIP) — один із запропонованих типів літієвих електричних акумуляторів із категорії вторинних електричних батарей, який відрізняється від звичайного літій-іонного акумулятора лише типом електроліту, що використовується при їх виготовленні. У випадку з Li-ion — це гелеподібний або рідкий електроліт, у випадку з Li-Pol — спеціальний щільний[1] полімер, насичений розчином літію. На сьогодні існує непорозуміння, викликане маркетинговим підходом. Представлені на ринку літій-полімерні акумулятори насправді є звичайними літій-іонними акумуляторами у пластиковому корпусі. Технічно вони відрізняються лише зовнішньою формою та оболонкою (так званий pouch-bag формат). Реальні літій-полімерні акумулятори через свої надзвичайно низькі характеристики не були представлені для продажу на ринку, хоча через їх перспективні переваги роботи по їх дослідженню та розробці проводяться і надалі


про публікацію авторської розробки
Додати розробку