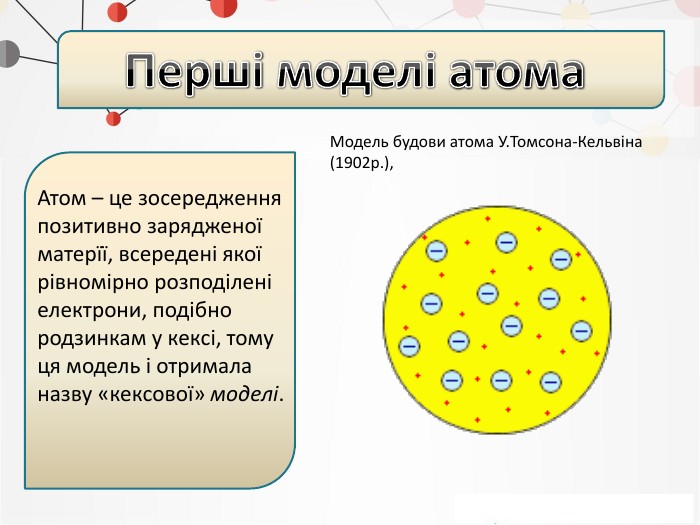
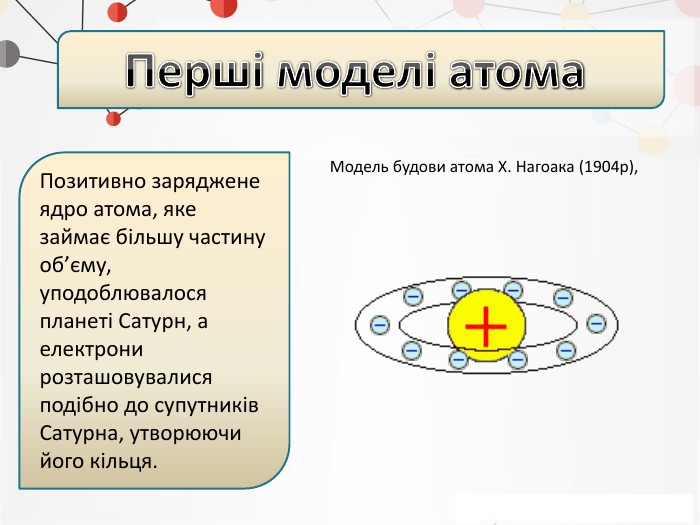
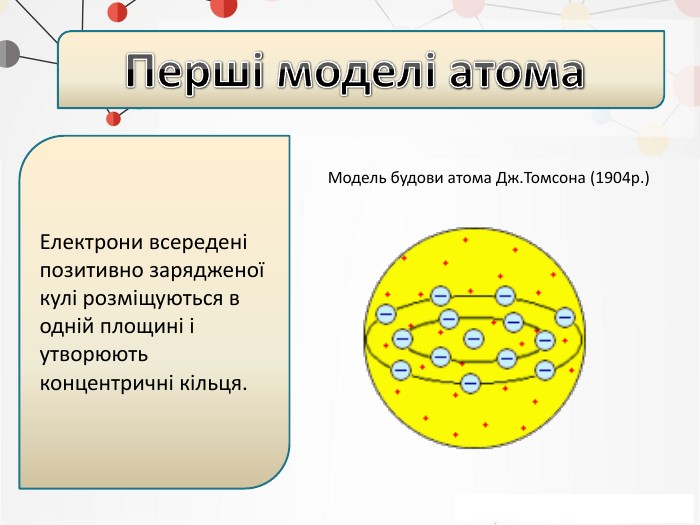
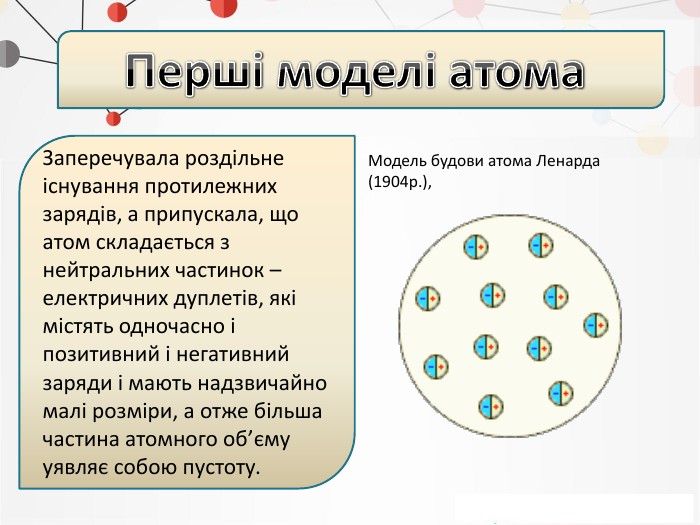
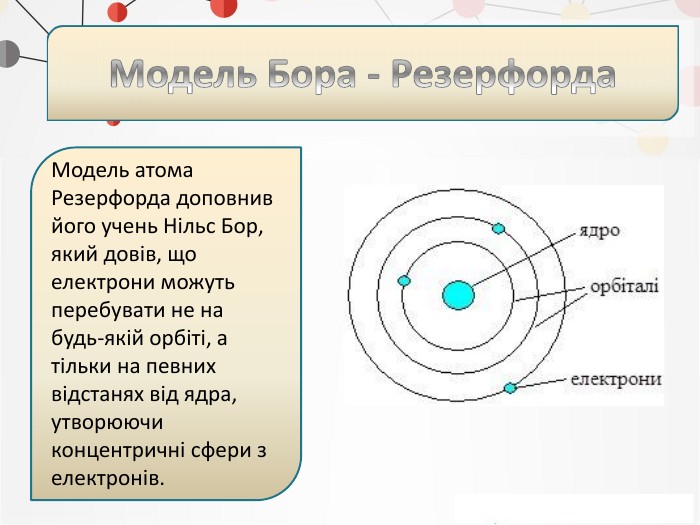
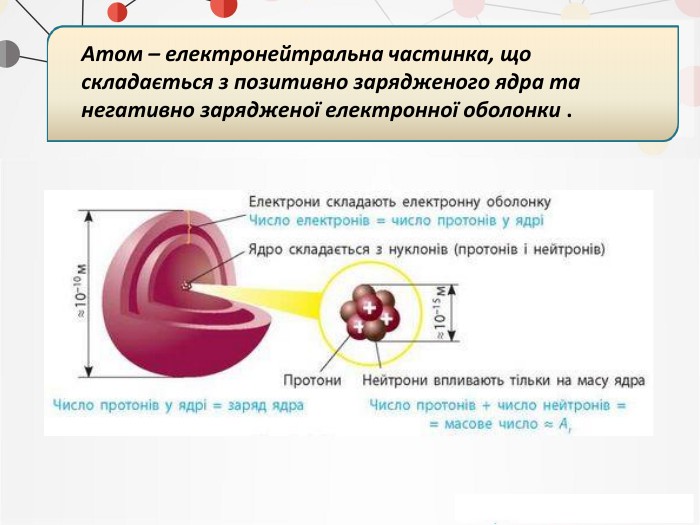
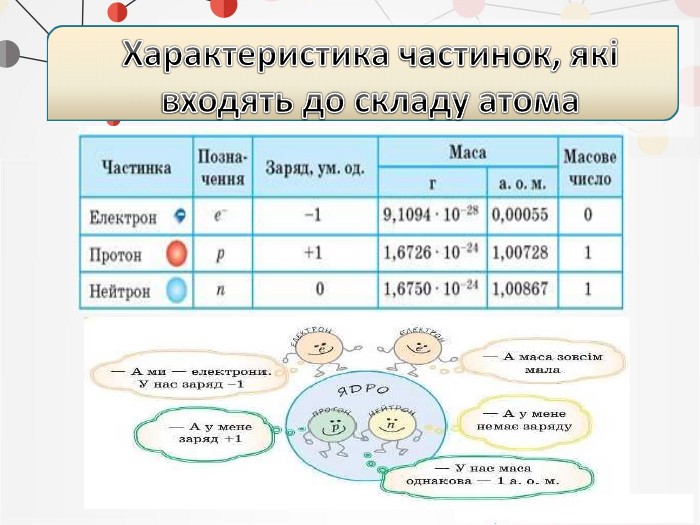
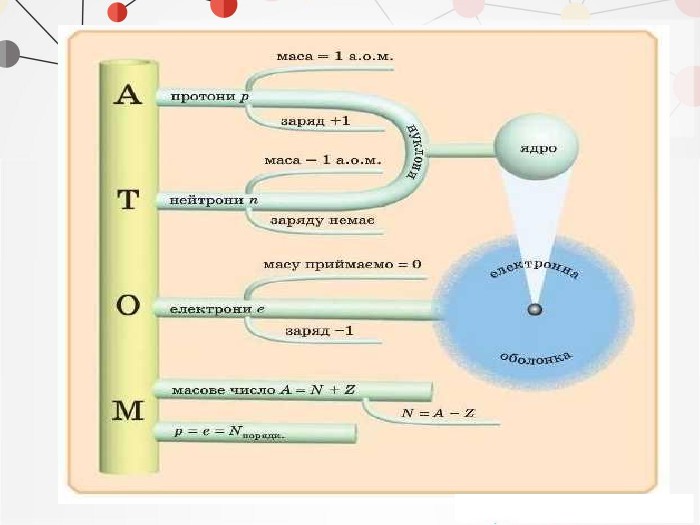
Презентація на тему: "Повторення основних понять про будову атома"
Про матеріал
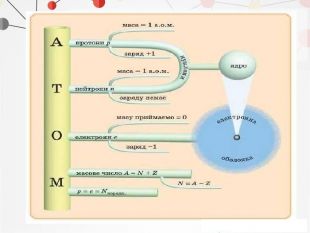
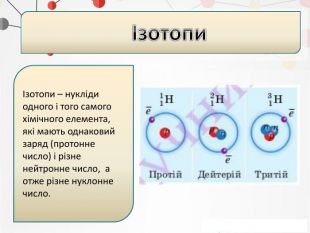
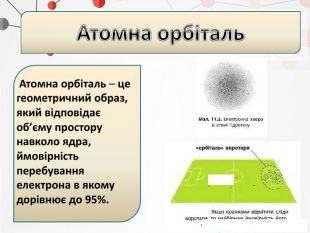
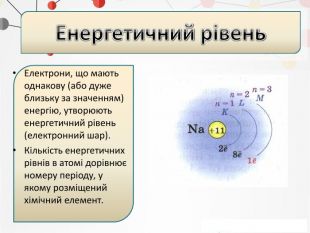
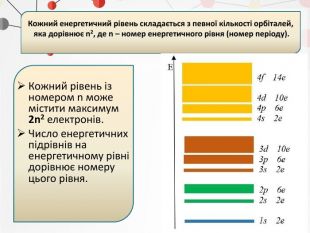
Презентація може бути використана на уроках хімії в 11 класі при вивченні теми "Періодичний закон і періодична система хімічних елементів" Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
-
-
Класна розробка!
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку