Презентація на тему: "Основні оксиди металічних елементів. Амфотерні оксиди"
Про матеріал
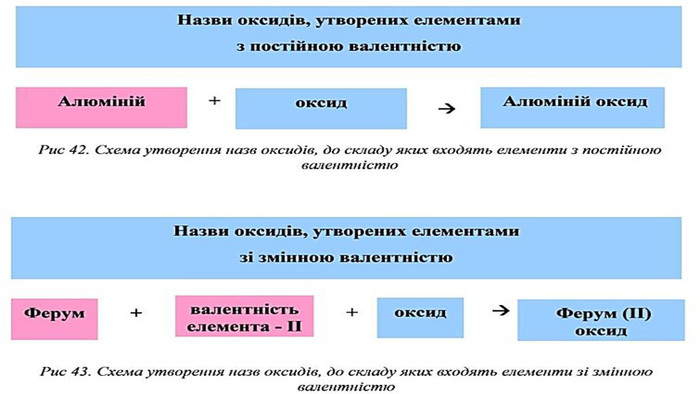
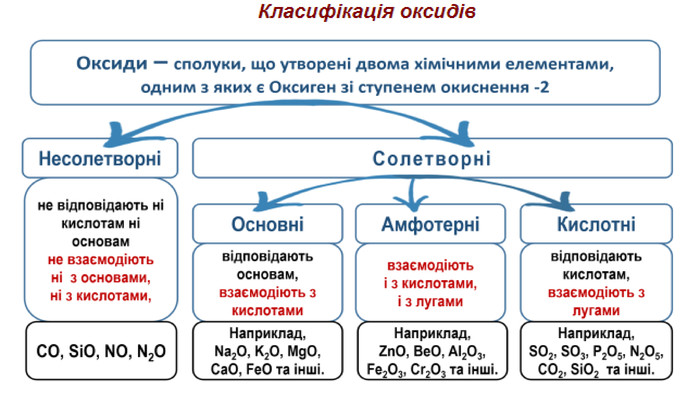
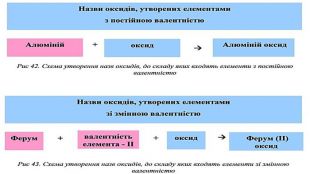
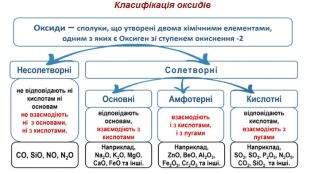
Оксидами називаються складні речовини, до яких входять два елементи, один з яких Оксиген.
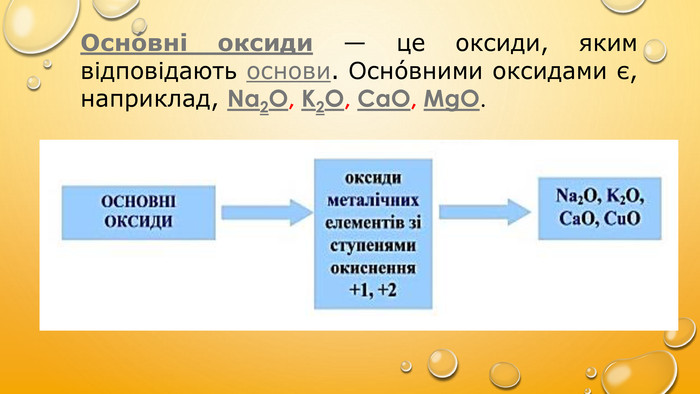
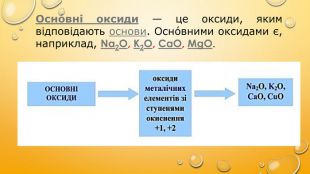
Осно́вні оксиди — це оксиди, яким відповідають основи. Осно́вними оксидами є, наприклад, Na2O, K2O, CaO, MgO.
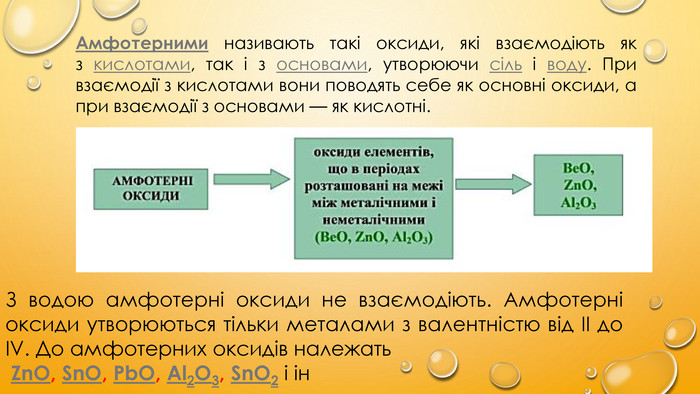
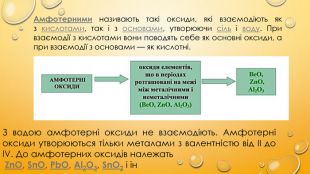
Амфотерними називають такі оксиди, які взаємодіють як з кислотами, так і з основами, утворюючи сіль і воду. При взаємодії з кислотами вони поводять себе як основні оксиди, а при взаємодії з основами — як кислотні.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку