Навчальний посібник з хімії "Хімія в таблицях"
Козирська О.І.

Навчальний посібник
м. Хмельницький
2013 р.
2
|
|
|
|
ББК |
24 я 721 |
|
УДК
|
542 (075) |
Розглянуто та рекомендовано до використання педагогічною радою ВПУ № 25 м. Хмельницького
(протокол № 10 від 17 травня 2012 р.)
Затверджено науковою радою НМЦ ПТО ПК у Хмельницькій області
(24 лютого 2013 р.)
Рецензенти:
Ганзюк А.Я. - кандидат технічних наук, доцент кафедри хімічної технології ХНУ
Березюк О.Я. - старший викладач, доцент кафедри хімії ХНУ
Козирська О.І. «Хімія в таблицях»: Навчальний посібник – Хмельницький: ВПУ №25 – 42 с.
Матеріали посібника подано у вигляді таблиць і охоплюють зміст загальноосвітньої програми з неорганічної та органічної хімії.
Подані матеріали мають різнобічну інформацію з хімії і доповнюють шкільний підручник.
3
ПЕРЕДМОВА
Хімія як навчальний предмет має важливе значення у загальноосвітній підготовці молоді. Яку б професію не обирала собі людина, їй необхідні поглиблені знання з хімії. Сучасна хімічна освіта вимагає від учнів не стільки енциклопедичного набору знань, скільки компетентнісного підходу до навчання, який розвиває здатність реалізувати знання у проблемній ситуації.
Саме в цьому допомагають матеріали посібника, які подані у вигляді таблиць, містять відомості про хімічні елементи, неорганічні та органічні речовини, приклади розв’язування розрахункових задач різного рівня складності, а також відомості про сучасну хімічну термінологію та номенклатуру.
Посібник стане у нагоді учням як під час роботи на уроці так і під час виконання домашніх завдань.
Робота з посібником допоможе учням формувати вміння мислити логічно та науково, викличе зростання інтересу до навчання та самоосвіти і буде сприяти вихованню пізнавального ставлення до діяльності.
4
ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д.І. МЕНДЕЛЄЄВА
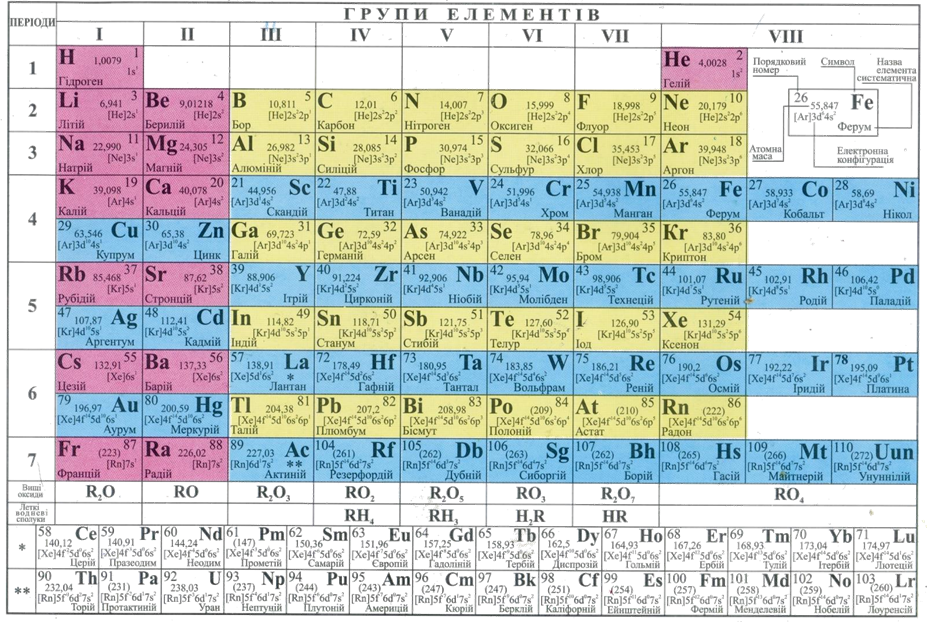
НАЗВИ ТА СИМВОЛИ ДЕЯКИХ ХІМІЧНИХ ЕЛЕМЕНТІВ
|
Протонне число |
Назва хімічного елемента |
Символ хімічного елемента (та як він вимовляється) |
|
1 |
Гідроген |
Н (аш) |
|
2 |
Гелій |
Не (гелій) |
|
3 |
Літій |
Lі (літій) |
|
4 |
Берилій |
Ве (берилій) |
|
5 |
Бор |
В (бор) |
|
6 |
Карбон |
С (це) |
|
7 |
Нітроген |
N (eн) |
|
8 |
Оксиген |
О (о) |
|
9 |
Флуор |
F (флуор) |
|
10 |
Неон |
Ne (неон) |
|
11 |
Натрій |
Na (натрій) |
|
12 |
Магній |
Мg (магній) |
|
13 |
Алюміній |
Аl (алюміній) |
|
14 |
Силіцій |
Si (силіцій) |
|
15 |
Фосфор |
Р (пе) |
|
16 |
Сульфур |
S (ес) |
|
17 |
Хлор |
Сl (хлор) |
|
18 |
Аргон |
Аr (аргон) |
|
19 |
Калій |
К (калій) |
|
20 |
Кальцій |
Са (кальцій) |
|
26 |
Ферум |
Fе (ферум) |
|
29 |
Купрум |
Си (купрум) |
|
30 |
Цинк |
Zn (цинк) |
|
35 |
Бром |
Вr (бром) |
|
47 |
Аргентум |
Аg (аргентум) |
|
56 |
Барій |
Ва (барій) |
ВАЛЕНТНІСТЬ ТА СТУПЕНІ ОКИСНЕННЯ ДЕЯКИХ МЕТАЛІВ І НЕМЕТАЛІВ
|
№ з/п |
Символ хімічного елемента |
Назва хімічного елемента |
Валентність |
Ступінь окиснення |
|
1 |
2 |
3 |
4 |
5 |
|
|
Метали |
|
|
|
|
1. |
Li |
Літій |
І |
+1 |
|
2. |
Na |
Натрій |
І |
+1 |
|
3. |
K |
Калій |
І |
+1 |
|
4. |
Mg |
Магній |
ІІ |
+2 |
|
5. |
Ca |
Кальцій |
ІІ |
+2 |
|
6. |
Ba |
Барій |
ІІ |
+2 |
|
7. |
Cu |
Купрум |
І; ІІ |
+1; +2 |
|
8. |
Ag |
Аргентум |
І |
+1 |
|
9. |
Zn |
Цинк |
ІІ |
+2 |
|
10. |
Al |
Алюміній |
ІІІ |
+3 |
|
11. |
Mn |
Манган |
ІІ; IV; VII |
+2; +4; +7 |
|
12. |
Fe |
Ферум |
II; III |
+2; +3 |
|
|
Неметали |
|
|
|
|
1. |
H |
Гідроген |
I |
-1; +1 |
|
2. |
C |
Карбон |
II; IV |
+2; +4; -4 |
|
3. |
Si |
Силіцій |
IV |
+4; -4 |
|
4. |
N |
Нітроген |
I; II; III; IV; V |
-3; +1; +2; +3; +4; +5 |
|
5. |
P |
Фосфор |
III; V |
-3; +3; +5 |
|
6. |
O |
Оксиген |
I; II |
-1; -2; +2 |
|
7. |
S |
Сульфур |
II; IV; VI |
-2; +4; +6 |
|
8. |
F |
Флуор |
I |
-1 |
|
9. |
Cl |
Хлор |
I; III; V; VII |
-1; +1; +3; +5; +7 |
|
10. |
Br |
Бром |
I; III; V; VII |
-1; +1; +3; +5; +7 |
|
11. |
I |
Йод |
I; III; V; VII |
-1; +1; +3; +5; +7 |
ХАРАКТЕРИСТИКА ХІМІЧНОГО ЕЛЕМЕНТА ЗА ПС
1. Назва
2. Символ
3. Протонне число
4. Атомна маса
5. Склад атома
6. Будова атома (ядерна)
7. Електронна конфігурація атома:
а) звичайна електронна формула
б) графічна електронна формула
8. Властивості атома (валентність та ступінь окиснення)
Символ Протонне число

ХАРАКТЕРИСТИКА ХІМІЧНОГО ЕЛЕМЕНТА № 3 ЗА ПС
ПРИКЛАД
1. Назва: Літій
2. Символ: Li (літій)
3. Протонне число: 3
4. Атомна маса: 7 нуклонне число (сума протонів і нейтронів) = 7
5. Склад атома: 7
Li
3 р = 3
ē = 3
n = 4 (7 – 3 = 4)
Атом Літію складається з 3 протонів, 3 електронів і 4 нейтронів.
6. Будова атома (ядерна)
Нуклід (ядро) атома Літію складається з 3 протонів і 4 нейтронів. Навколо ядра обертаються 3 електрона.
7. Електронна конфігурація (звичайна і графічна електронні формули).
7
3Li 1S22S1
|
|
|
|
↑↓ ↑
1S2 2S1 2p0
8. Властивості атома (валентність і ступінь окиснення)
Li(І); Li1
ХАРАКТЕРИСТИКА ХІМІЧНОГО ЕЛЕМЕНТА № 17 ЗА ПС
ПРИКЛАД
1. Назва: Хлор
2. Символ: Cl (хлор)
3. Протонне число: 17
4. Атомна маса: 35 нуклонне число (сума протонів і нейтронів) = 35
5. Склад атома: 35Cl
17 р = 17
ē = 17
n = 18 (35-17=18)
Атом Хлору складається з 17 протонів, 17 електронів і 18 нейтронів.
6. Будова атома (ядерна)
Нуклід (ядро) атома Хлору складається з 17 протонів і 18 нейтронів. Навколо ядра обертаються 17 електронів.
7. Електронна конфігурація (звичайна і графічна електронні формули).
1735Cl 1S22S22p63S23p5
|
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑↓ |
↑ |
|
|
|
|
|
|
↑↓ ↑↓
1S2 2S2 2p6 3S2 3p5 3d0
8. Властивості атома (валентність і ступінь окиснення)
Cl (I); Cl1 ; Cl1
Cl (III); Cl 3
Cl (V); Cl5
Cl (VII); Cl7
СХЕМА ПОЗНАЧЕННЯ ГРАФІЧНОЇ ЕЛЕКТРОННОЇ ФОРМУЛИ
|
n=1
|
1s |
|
|
|
|
n=2 ![]()
2s 2p
n=3 ![]()
3s 3p 3d
ПРИКЛАДИ ЕЛЕКТРОННОЇ КОНФІГУРАЦІЇ АТОМІВ ХІМІЧНИХ ЕЛЕМЕНТІВ
1) Електронна конфігурація атома Карбону
126C 1s22s22p2
![]()
1s2 2s2 2p2
126C*
![]()
1s2 2s1 2p3
2) Електронна конфігурація атома Натрію
1123Na 1s22s22p63s1
![]()
1s2 2s2 2p6 3s1 3p0 3d0
3) Електронна конфігурація атома Хлору
1735Cl 1s22s22p63s23p5
|
|
|
1s2 2s2 2p6 3s2 3p5 3d0
1735Cl*
n=3 ![]()
3s2 3p4 3d1
1735Cl**
n=3 ![]()
3s2 3p3 3d2
35Cl***
17
n=3 ![]()
3s1 3p3 3d3
ТИПИ ХІМІЧНИХ ЗВ’ЯЗКІВ ТА ЇХ ОЗНАКИ
|
Тип зв’язку |
Частинки, що сполучаються |
Частинки, що утворюються |
Схема утворення |
Приклад |
|
Іонний |
Атоми елементів, що значно відрізняються за електронегативністю |
Позитивно і негативно зарядженні іони |
Na ∙ + ∙Cl : → Na∙ ∙ + [:Cl∙ ∙:] - ∙ ∙ ∙ ∙ |
NaCl, CaO, KOH |
|
Ковалентний поляр- ний
неполярний |
Атоми елементів, близьких за електро- негативністю
Атоми одного й того самого елемента |
Молекули
Молекули |
∙ ∙ ∙ ∙ Н ∙ + ∙Cl : → H: C: ∙ ∙ ∙ ∙ Усуспільнення валентих електронів, утворення електронних пар
|
HCl, CH4 CO2,
Cl2, H2, Br2 |
|
Металічне |
Атоми металів |
Іон-атоми, електрони |
Утворення іон-атомів та «елетронного газу» |
Метали та їх сплави |
* Примітка: Базелюк І.І., Величко Л.П., Титаренко Н.В.Довідкові матеріали з хімії.
ПРИКЛАДИ ХІМІЧНОГО ЗВ’ЯЗКУ
1. Ковалентний неполярний зв’язок (виникає між атомами одного хімічного елемента – неметала)
а) Електронна конфігурація атома Гідрогену:
1H 1s1
1
![]()
1s1
Атом Гідрогену має один неспарений електрон, який у схемі зв’язку позначається крапкою Н•.
Схема утворення молекули водню:
Н• •Н
Н – Н
Н2
Молекула водню Н2 утворена за рахунок ковалентного неполярного зв’язку.
б) Електронна конфігурація атома Оксигену:
168O 1s22s22p4
![]()
1s2 2s2 2p4
На останньому енергетичному рівні атом Оксигену має шість електронів: чотири спарених, і два – неспарених:
![]()
Схема утворення молекули кисню:
∙∙ ∙ ∙ ∙∙ О∙∙ ∙ ∙ О∙∙
О = О
О2
Молекула кисню утворена за рахунок подвійного ковалентного неполярного зв’язку.
2. Ковалентний полярний зв’язок (виникає між атомами різних неметалів).
Схема утворення молекули води:
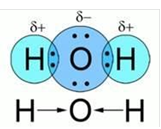
Н2О
Молекула води Н2О утворена за рахунок двох ковалентних полярних зв’язків.
3. Йонний зв’язок (виникає між атомами хімічних елементів, що різко відрізняються між собою за електронегативністю).
Схема утворення молекули кухонної солі
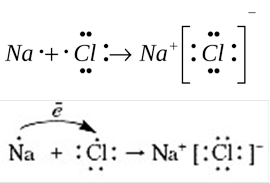
NaCl
Молекула натрій хлориду NaCl утворена за рахунок йонного зв’язку.
ХАРАКТЕРИСТИКА МОЛЕКУЛИ РЕЧОВИНИ
ПРИКЛАД
Завдання. Визначте назву, склад молекули та розрахуйте молярну масу для формули Ba (OH)2.
Відповідь.
1) Ba (OH)2 – барій гідроксид.
2) Молекула барій гідроксиду Ba (OH)2 складається з трьох хімічних елементів: Барію (Ba), Оксигену (O), Гідрогену (H).
Ba – 1 атом
O – 2 атома
H – 2 атома
![]()
Всього – 5 атомів
3) М(Ba(OH)2) = А(Ba) + А(O) · 2 + А(H) · 2 = 137 + 16 · 2 + 1 · 2 = 171 г/моль
ЕЛЕКТРОХІМІЧНИЙ РЯД НАПРУГИ МЕТАЛІВ
Li K Ba Ca Na Mg Al Mn Zn Cr Fe Cd Ni Sn Pb (H2) Cu Hg Ag Pt Au
ТАБЛИЦЯ ЕЛЕКТРОНЕГАТИВНОСТІ НЕМЕТАЛІВ
|
Неметал |
Si |
B |
H |
P |
C |
S |
I |
Br |
Cl |
N |
O |
F |
|
Величина електронегативність |
1,9 |
2,0 |
2,1 |
2,2 |
2,5 |
2,6 |
2,6 |
2,8 |
3,0 |
3,07 |
3,5 |
4,0 |
17
СХЕМА СКЛАДАННЯ ФОРМУЛ РЕЧОВИН
Молекулярна формула речовини записується в такій послідовності: спочатку катіон, потім аніон.
Варіант №1. Якщо цифри зарядів катіону та аніону однакові, то формула речовини записується без змін:
а) Na 1+ і Cl 1- б) Ba 2+ і SO4 2- в) Al3+ і PO43-
NaCl BaSO4 AlPO4
Варіант №2. Якщо цифри зарядів катіону та аніону різні, то їх переносять навхрест і вони стають індексами:
а) Na 1+ і SO4 2- б) Ca2+і OH 1- в) Al3+ і SO42-
Na1+![]() SO
SO42- Ca2+ OH1- Al3+ SO42-
![]()
|
Na2(SO4)1 |
Ca1(OH)2 Al2(SO4)3 |
|
Na2SO4 |
Ca(OH)2 Al2(SO4)3 |
СКЛАД МОЛЕКУЛ ОСНОВНИХ КЛАСІВ НЕОРГАНІЧНИХ РЕЧОВИН
|
№ п/п |
Клас неорганічної речовини |
Визначення |
Приклади |
Утворення назви речовини |
|
1 |
Оксиди |
Оксиди – це речовини, молекули яких складаються з двох хімічних елементів, один з яких Оксиген |
СО2, Н2О, Na2O, CaO |
До назви катіону додають його валентність (якщо вона змінна) і слово оксид |
|
2 |
Основи |
Основи – це речовини, молекули яких складаються з катіону металу та однієї чи кількох гідроксильних груп |
NaOH, Mg(OH)2, Al(OH)3 |
До назви катіону додають його валентність (якщо вона змінна) і слово гідроксид |
|
3 |
Кислоти |
Кислоти – це речовини, молекули яких складаються з одного чи кількох атомів гідрогену та кислотного залишку |
HCl, H2SO4, H3PO4 |
До назви аніону додають закінчення – на і слово кислота |
|
4 |
Солі |
Солі – це речовини, молекули яких складаються з атомів металу та кислотного залишку |
NaCl, CaCl2, Al2(SO4)3 |
До назви катіону додають його валентність (якщо вона змінна) і назву аніону |
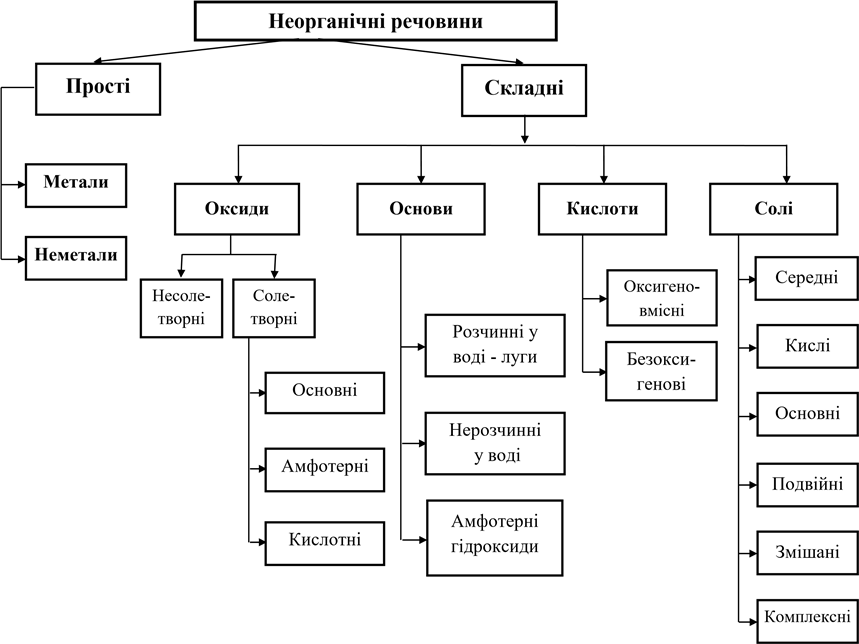
КЛАСИФІКАЦІЯ НЕОРГАНІЧНИХ РЕЧОВИН
РОЗЧИННІСТЬ КИСЛОТ, ОСНОВ ТА СОЛЕЙ У ВОДІ
|
А н і о н и |
|
|
Катіони |
|||||||||||||||
|
H+ |
K+ |
Na+ |
NH +4 |
Ba2+ |
Ca2+ |
Mg2+ |
Al3+ |
Mn2+ |
Cr3+ |
Fe2+ |
Fe3+ |
Zn2+ |
Pb2+ |
Sn2+ |
Cu2+ |
Ag+ |
Hg2+ |
|
|
- OH |
|
р |
р |
р |
р |
м |
н |
н |
н |
н |
н |
н |
н |
м |
– |
н |
– |
– |
|
- Cl |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
м |
р |
р |
н |
р |
|
- Br |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
м |
р |
р |
н |
м |
|
- I |
р |
р |
р |
р |
р |
р |
р |
р |
р |
– |
р |
– |
р |
н |
м |
– |
н |
н |
|
S2- |
р |
р |
р |
р |
– |
– |
– |
– |
н |
– |
н |
н |
н |
н |
н |
н |
н |
н |
|
SO32- |
р |
р |
р |
р |
м |
н |
м |
– |
– |
– |
м |
– |
н |
н |
– |
– |
м |
– |
|
SO42- |
р |
р |
р |
р |
н |
м |
р |
р |
р |
р |
р |
р |
р |
м |
р |
р |
м |
– |
|
СO32- |
р |
р |
р |
р |
н |
н |
м |
– |
н |
– |
н |
– |
н |
н |
– |
– |
м |
н |
|
- NO3 |
р |
р |
р |
р |
р |
р |
р |
р |
р |
Р |
р |
р |
р |
р |
р |
р |
р |
р |
|
PO43- |
р |
р |
р |
р |
н |
н |
м |
н |
н |
н |
н |
м |
н |
н |
н |
н |
н |
н |
|
SiO32- |
н |
р |
Р |
– |
н |
н |
– |
– |
н |
– |
н |
– |
н |
н |
– |
– |
– |
– |
|
CH3COO- |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
р |
– |
р |
р |
р |
р |
р |
р |
Р – розчинні; М – малорозчинні; Н – нерозчинні; «–» – розкладаються водою або не існують
* Примітка: Зеленєва О.Г. Хімія 8-11 клас: Довідник школяра і студента.
ТАБЛИЦЯ КАТІОНІВ ТА АНІОНІВ
|
|
|
КАТІОНИ |
|
|
|
АНІОНИ |
|
|
№ з/п |
Формула |
Назва |
Валентність |
№ з/п |
Формула |
Назва |
Валентність |
|
1 |
H+ |
гідроген |
І |
1 |
OH - |
гідроксид |
І |
|
2 |
K+ |
калій |
І |
2 |
Cl - |
хлорид |
І |
|
3 |
Na+ |
натрій |
І |
3 |
Br- |
бромід |
І |
|
4 |
NH4+ |
амоній |
І |
4 |
I - |
йодид |
І |
|
5 |
Ba2+ |
барій |
ІІ |
5 |
S2- |
сульфід |
ІІ |
|
6 |
Ca2+ |
кальцій |
ІІ |
6 |
SO32- |
сульфіт |
ІІ |
|
7 |
Mg2+ |
магній |
ІІ |
7 |
SO42- |
сульфат |
ІІ |
|
8 |
Al3+ |
алюміній |
ІІІ |
8 |
CO32- |
карбонат |
ІІ |
|
9 |
Fe2+ |
ферум (ІІ) |
ІІ |
9 |
NO3- |
нітрат |
І |
|
10 |
Fe3+ |
ферум (ІІІ) |
ІІІ |
10 |
PO43- |
фосфат |
ІІІ |
|
11 |
Zn2+ |
цинк |
ІІ |
11 |
SiO32- |
силікат |
ІІ |
|
12 |
Pb2+ |
плюмбум |
ІІ |
12 |
CH3COO- |
ацетат |
І |
|
13 |
Cu2+ |
купрум (ІІ) |
ІІ |
13 |
O-2 |
оксид |
ІІ |
|
14 |
Cu+ |
купрум (І) |
І |
|
|
|
|
|
15 |
Ag+ |
арґентум |
І |
|
|
|
|
ТАБЛИЦЯ ДЕЯКИХ НЕМЕТАЛІВ ТА ЇХ ВІДПОВІДНИХ СПОЛУК
|
№ групи |
Хімічні елементи |
|
Відповідні сполуки |
|
|
|||||
|
Назва |
Сим вол |
Прості |
|
Складні |
|
|
||||
|
|
Оксиди |
Кислоти |
|
Солі |
||||||
|
Фор мула |
Назва |
Фор мула |
Назва |
Фор мула |
Назва |
Фор мула |
Назва |
|||
|
VII |
Флуор |
F |
F2 |
Фтор |
OF2 |
Дифлуорид оксигену |
HF |
Флуоридна к-та (плавікова) |
NaF |
Натрій флуорид |
|
Хлор |
Cl |
Cl2 |
Хлор |
Cl2O7 |
Хлор (VII) оксид |
HCl |
Хлоридна к-та (соляна) |
NaCl |
Натрій хлорид |
|
|
Бром |
Br |
Br2 |
Бром |
Br2O5 |
Бром (V) оксид |
HBr |
Бромідна к-та |
NaBr |
Натрій бромід |
|
|
Йод |
I |
I2 |
Йод |
I2O5 |
Йод (V) оксид |
HI |
Йодидна к-та |
NaI |
Натрій йодид |
|
|
VІ |
Оксиген |
O |
O2 |
Кисень |
|
|
|
|
|
|
|
O3 |
Озон |
|||||||||
|
Сульфур |
S |
S |
Сірка |
SO2 |
Сульфур (IV) оксид |
H2SO3 |
Сульфітна к-та |
Na2SO3 |
Натрій сульфіт |
|
|
|
|
|
|
SO3 |
Сульфур (VI) оксид |
H2SO4 |
Сульфатна к-та |
NaHSO3 |
Натрій гідрогенсульфіт |
|
|
|
|
|
|
Na2SO4 |
Натрій сульфат |
|||||
|
NaHSO4 |
Натрій гідрогенсульфат |
|||||||||
|
CuSO4 · 5 H2O |
Мідний купорос |
|||||||||
|
H2S |
Сульфідна к-та |
Na2S |
Натрій сульфід |
|||||||
|
№ групи |
Хімічні елементи |
|
Відповідні сполуки |
|
|
|||||
|
Назва |
Сим вол |
Прості |
|
Складні |
|
|
||||
|
|
Оксиди |
Кислоти |
|
Солі |
||||||
|
Фор мула |
Назва |
Фор мула |
Назва |
Фор мула |
Назва |
Фор мула |
Назва |
|||
|
V |
Нітроген
|
N
|
N2
|
Азот
|
NO |
Нітроген (ІІ) оксид |
|
|
|
|
|
NO2 |
Нітроген (ІV) оксид
|
HNO2 |
Нітритна к-та |
NaNO2 |
Натрій нітрит |
|||||
|
HNO3 |
Нітратна к-та |
NaNO3 |
Натрій нітрат |
|||||||
|
Фосфор |
P |
P |
Фосфор |
P2O5 |
Фосфор (V) оксид |
H3PO4 |
Фосфатна к-та |
Na3PO4 |
Натрій фосфат |
|
|
NaH2PO4 |
Натрій дигідрогенфосфат |
|||||||||
|
Na2HPO4 |
Натрій гідрогенфосфат |
|||||||||
|
IV |
Карбон
|
C
|
C
|
Вуглець
|
CO
|
Карбон (ІІ) оксид (чадний газ) |
|
|
|
|
|
CO2 |
Карбон (IV) оксид (вуглекислий газ) |
H2CO3
|
Карбонатна к-та
|
CaCO3 |
Кальцій карбонат |
|||||
|
MgCO3 |
Магній карбонат |
|||||||||
|
Ca(HCO3)2 |
Кальцій гідрогенкарбонат |
|||||||||
|
Mg(HCO3)2 |
Магній гідрогенкарбонат |
|||||||||
|
Силіцій |
Si |
Si |
Силіцій |
SiO2
|
Силіцій (IV) оксид (кремнезем, річковий пісок) |
H2SiO3 |
Силікатна к-та
|
Na2SiO3 |
Натрій силікат (рідке скло) |
|
|
K2SiO3 |
Калій силікат (рідке скло) |
|||||||||
ТАБЛИЦЯ ДЕЯКИХ МЕТАЛІВ ТА ЇХ ВІДПОВІДНИХ СПОЛУК
|
№ групи |
Хімічні елементи |
Відповідні сполуки |
|
|
||||||
|
Назва |
Символ |
Прості |
Складні |
|
|
|||||
|
Оксиди |
Гідроксиди |
|
Солі |
|||||||
|
Формула |
Назва |
Формула |
Назва |
Формула |
Назва |
Формула |
Назва |
|||
|
І |
Натрій |
Na |
Na |
Натрій |
Na2O |
Натрій оксид |
NaOН |
Натрій гідроксид, ідкий натр, каустик |
NaCl |
Натрій хлорид |
|
Калій |
K |
K |
Калій |
K2O |
Калій оксид |
КОН |
Калій гідроксид, ідке калі |
КCl |
Калій хлорид |
|
|
ІІ |
Магній |
Mg |
Mg |
Магній |
MgO |
Магній оксид |
Mg(OН)2 |
Магній гідроксид |
MgSO4 |
Магній сульфат |
|
Кальцій |
Ca |
Ca |
Кальцій |
CaO |
Кальцій оксид, негашене вапно |
Ca(OН)2 |
Кальцій гідроксид, вапняна вода, гашене вапно |
CaCO3 |
Кальцій карбонат, вапняк, мармур, крейда |
|
|
ІІІ |
Алюмі ній |
Аl |
Аl |
Алюміній |
Аl2О3 |
Алюміній оксид |
Аl(ОН)3 |
Алюміній гідроксид |
АlCl3
Na3[Al(ОН)6] |
Алюміній хлорид
Гексагідроксоалюм інат натрію |
|
№ групи |
Хімічні елементи |
|
Відповідні сполуки |
|
|
|||||
|
Назва |
Символ |
Прості |
Складні |
|
|
|||||
|
Оксиди |
Гідроксиди |
|
Солі |
|||||||
|
Формула |
Назва |
Формула |
Назва |
Формула |
Назва |
Формула |
Назва |
|||
|
VIІІ |
Ферум |
Fe |
Fe |
Залізо |
FeО |
Ферум (ІI) оксид |
Fe(ОН)2 |
Ферум (ІІ) гідрооксид |
FeSO4 |
Ферум (ІІ) сульфат |
|
FeSO4 · 7Н2О |
Залізний купорос |
|||||||||
|
Fe2О3 |
Ферум (ІIІ) оксид |
Fe(ОН)3 |
Ферум (ІІІ) гідрооксид |
FeCl3
Na3[Fe(ОН)6] |
Ферум (ІІІ) хлорид
Гексагідроксоферрат натрію |
|||||
|
Fe3О4 (FeО·Fe2О3) |
Залізна окалина Ферум (ІІ, ІІІ) оксид |
|
|
|
|
|||||
ХІМІЧНІ ВЛАСТИВОСТІ ОСНОВНИХ КЛАСІВ НЕОРГАНІЧНИХ РЕЧОВИН
|
Речовини |
Характерні реакції |
|
|||||
|
з неметалами |
з кислотними оксидами |
з амфотерними оксидами |
з кислотами |
з амфотерними гідроксидами |
з солями |
з водою |
|
|
Метали |
t 2Na+Cl2= =2NaCl t Fe+S=FeS |
t 2Mg+SiO2= =2MgO+Si |
– |
Zn+2HCl= = ZnCl2+H2 ↑ |
– |
Fe+CuSO4 = =Cu + FeSO4 |
2Na+2H2O= =2NaOH+H2↑; Zn+H2O= =ZnO+H2↑ |
|
Основні оксиди |
– |
– |
t CaO+ZnO= =CaZnO2 |
t CuO+H2SO4= =CuSO4+H2O |
t CaO+Zn(OH)2= =CaZnO2+H2O |
– |
Na2O+H2O= =2NaOH |
|
Амфотерні оксиди |
– |
– |
– |
– |
– |
– |
– |
|
Луги |
2KOH+Cl2= =KClO+ +KCl+H2O |
Ca(OH)2+CO2= =CaCO3+H2O |
t 2NaOH+ZnO= =Na2ZnO2+ +H2O |
NaOH+HCl= =NaCl+H2O |
2NaOH+ +Zn(OH)2= =Na2ZnO2+ +2H2O |
2NaOH+ +CuSO4= =Cu(OH)2+ +Na2SO4 |
Утворюються кристалогідра ти з різним вмістом води |
|
Речовини |
Характерні реакції |
|
|
||||
|
з неметалами |
з кислотними оксидами |
з амфотерними оксидами |
з кислотами |
з амфотерними гідроксидами |
з солями |
з водою |
|
|
Нерозчинні основи |
– |
Mg(OH)2+SO3= =MgSO4+H2O |
t Mg(OH)2+ZnO= =MgZnO2+H2O |
Mg(OH)2+ +2HCl= =MgCl2+ +2H2O |
Ba(OH)2+ +Zn(OH)2= =BaZnO2+ +2H2O |
– |
– |
|
Амфотерні гідроксиди |
– |
Zn(OH)2+SO3= =ZnSO4+H2O |
– |
Zn(OH)2+ +2HCl= =ZnCl2+2H2O |
– |
– |
– |
|
Солі |
– |
CaCO3+ t +SiO2= =CaSiO3+ +CO2↑ |
t Na2CO3+Al2O3= =2NaAlO2+CO2 |
Na2CO3+ +2HCl= =2NaCl+ +H2O+CO2↑ |
– |
Na2SO4+ +BaCl2= =BaSO4+ +2NaCl |
CuSO4+5H2O= =CuSO4∙5H2O |
|
Вода |
H2O+Cl2= =HCl+HClO |
H2O+SO3= =H2SO4 |
– |
nH2O+H2SO4= H2SO4∙nH2O |
– |
FeSO4+7H2O= =FeSO4∙7H2O |
– |
* Примітка: Базелюк І.І., Величко Л.П., Титаренко Н.В.Довідкові матеріали з хімії.
ОСНОВНІ КЛАСИ ОРГАНІЧНИХ РЕЧОВИН
|
№ з/п |
Клас речовини |
Загальна формула гомологічного ряду |
Перші представники |
Ознака класу |
||
|
Назва |
Молекулярна формула |
Структурна формула |
||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
1. |
Насичені вуглеводні (алкани) |
СnH2n+2 |
метан
етан
пропан |
CH4
C2H6
C3H8 |
Н
СН3 – СН3
СН3 – СН2 – СН3 |
Алкани у карбоновому ланцюгу між карбонами мають одинарний зв’язок, що називають насиченим. Відстань між атомами Карбону дорівнює 0,154 нм, кут між ними – 109,280 |
|
2. |
Ненасичені вуглеводні:
а) алкени
б) алкіни |
CnH2n |
етен (етилен)
пропен (пропілен)
етин (ацетилен) |
C2H4
C3H6
C2H2 |
СН2=СН2
СН3 – СН = СН2
CH ≡ CH |
Ненасичені вуглеводні у карбоновому ланцюгу між карбонами мають кратний зв’язок: подвійний (у алкенів) або потрійний (у алкінів). У алкенів відстань між атомами Карбону дорівнює 0,134 нм, кут - 1200. У алкінів відповідно 0,120 нм, кут - 1800 |
|
CnH2n-2 |
пропін |
C3H4 |
CH |
|||
|
3. |
Ароматичні вуглеводні (арени) |
|
бензен (бензол) |
C6H6 |
НС СН СН |
Арени мають ароматичний зв’язок: замкнутий цикл карбонового ланцюга, що має єдину шестиелектронну хмару, що в рівній мірі належить всім шести атомам Карбону
|
|
ГІДРОКСОПОХІДНІ ВУГЛЕВОДНІВ |
||||||
|
4. |
Спирти:
а) насичені одноатомні
б) багатоатомні |
R – OH
CnH2n+1OH |
метанол (метиловий спирт)
етанол (етиловий спирт)
пропанол (пропіловий спирт)
|
CH3OH
C2H5OH
C3H7OH |
CH3 – OH
C2H5 – OH
C3H7 – OH |
У своєму складі спирти мають одну або декілька функціональних спиртових груп -ОН. Насичені одноатомні спирти мають одну групу -ОН. Багатоатомні - кілька груп -ОН. |
|
|
гліцерин |
C3H5(OH)3 |
OH OH OH |
|||
|
5. |
Феноли |
|
фенол |
C6H5OH |
OH
|
У своєму феноли мають функціональну спиртову групу, що безпосередньо пов’язана з ароматичним кільцем. |
|
6. |
Альдегіди |
R – C H
CnH2n+1CHO |
метаналь (мурашиний альдегід)
етаналь (оцтовий альдегід) |
HCHO
CH3CHO |
O H – C
O CH3 – C H |
У своєму складі альдегіди мають карбонільну групу
сполучену з воднем та вуглеводневим радикалом |
|
7. |
Насичені одноосновні карбонові кислоти |
R – C ОH
CnH2n+1COOH |
метанова (мурашина) кислота
етанова (оцтова) кислота
пропанова (пропіонова) кислота
|
HCOOH
CH3COOH
C2H5COOH |
H – C
O
ОH
C2H5 – C |
Насичені одноосновні карбонові кислоти в своєму складі мають функціональну карбоксильну групу: С ОН що сполучена з вуглеводневим радикалом |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
8. |
Естери |
O
O – R1 |
етилетаноат (етилацетат, етиловий ефір оцтової кислоти) |
СН3 - СОО - С2Н5 |
СН3 - С О - С2Н5 |
У своєму складі естери (складні ефіри) мають два вуглеводневих радикали (однакових чи різних), що сполучені групою: О
О |
|
9. |
Жири |
СН2 – СОО – R
СН2 – СОО – R |
Тристеарат гліцерину |
|
СН – СОО – С17Н35
СН2 – СОО – С17Н35 |
Жири є естерами гліцерину та вищих карбонових кислот |
|
Триолеат гліцерину |
|
СН2 – СОО – С17Н33
СН – СОО – С17Н33
|
||||
|
|
|
|
|
|
СН2 – СОО – С17Н33 |
|
|
10. |
Вуглеводи |
|
Глюкоза Сахароза Крохмаль Целюлоза |
С6Н12О6 С12Н22О11 (С6Н10О5)n (С6Н10О5)n |
|
|
|
11. |
Амінокислоти |
R H2N – CH –COOH α-амінокислота |
Гліцин |
H2N – CH2 – COOH |
Н – N – CH2 – C OH H |
У своєму складі амінокислоти мають одну (або кілька) карбоксильних груп – COOH і одну (або кілька) аміногруп –NH2 |
ТАБЛИЦЯ ВУГЛЕВОДНІВ
|
№ з/п |
Алкани |
Алкени |
Алкіни |
|||
|
Мають одинарний зв’язок між карбонами у карбоновому ланцюгу |
Мають один подвійний зв’язок між карбонами у карбоновому ланцюгу |
Мають один потрійний зв’язок між карбонами у карбоновому ланцюгу |
||||
|
Загальна формула гомологічного ряду СnH2n+2 |
Назва |
Загальна формула гомологічного ряду СnH2n |
Назва |
Загальна формула гомологічного ряду СnH2n-2 |
Назва |
|
|
1. |
CH4 |
метан |
– |
– |
– |
– |
|
2. |
C2H6 |
етан |
C2H4 |
етен, етилен |
C2H2 |
етин, ацетилен |
|
3. |
C3H8 |
пропан |
C3H6 |
пропен, пропілен |
C3H4 |
пропін |
|
4. |
C4H10 |
бутан |
C4H8 |
бутен |
C4H6 |
бутин |
|
5. |
C5H12 |
пентан |
C5H10 |
пентен |
C5H8 |
пентин |
|
6. |
C6H14 |
гексан |
C6H12 |
гексен |
C6H10 |
гексин |
|
7. |
C7H16 |
гептан |
C7H14 |
гептен |
C7H12 |
гептин |
|
8. |
C8H18 |
октан |
C8H16 |
октен |
C8H14 |
октин |
|
9. |
C9H20 |
нонан |
C9H18 |
нонен |
C9H16 |
нонін |
|
10. |
C10H22 |
декан |
C10H20 |
децен |
C10H18 |
децин |
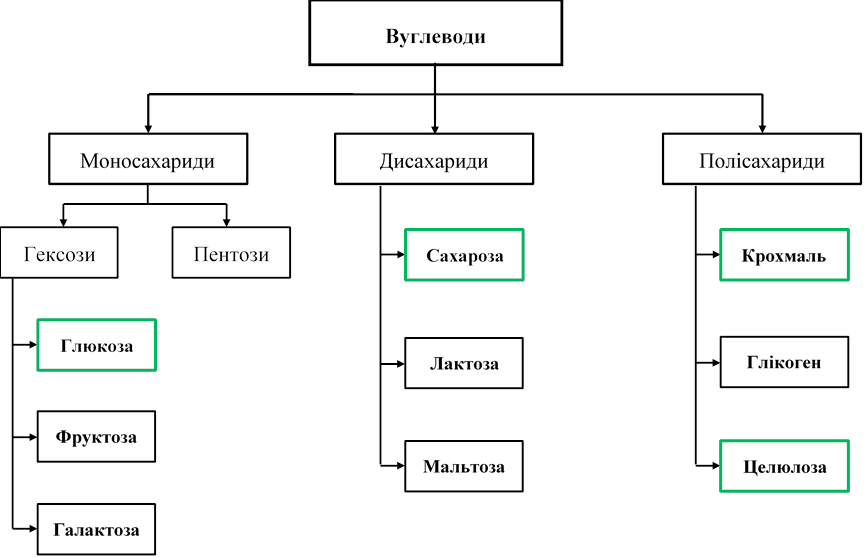
КЛАСИФІКАЦІЯ ВУГЛЕВОДІВ
БУДОВА МОЛЕКУЛИ ГЛЮКОЗИ
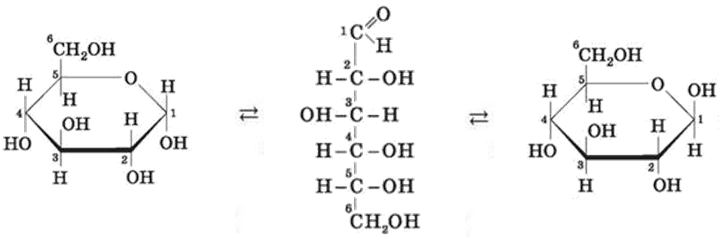
![]() ά - циклічна форма
ά - циклічна форма ![]() альдегідна форма β - циклічна форма
альдегідна форма β - циклічна форма
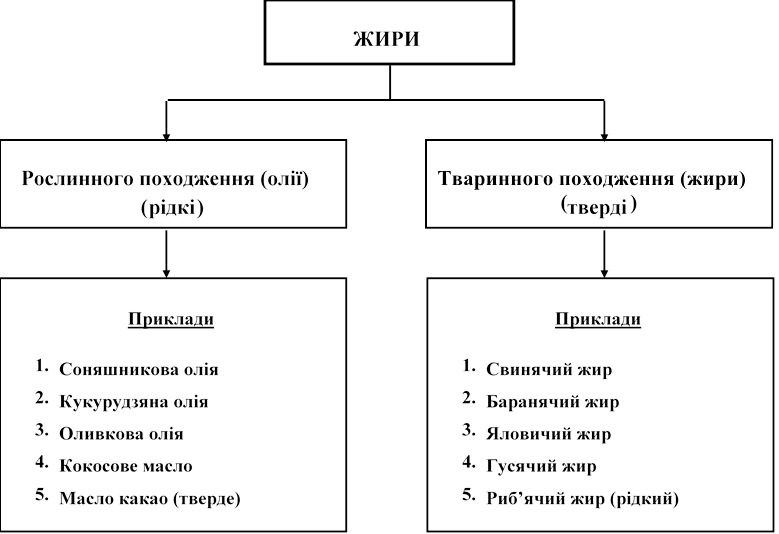
КЛАСИФІКАЦІЯ ЖИРІВ
35
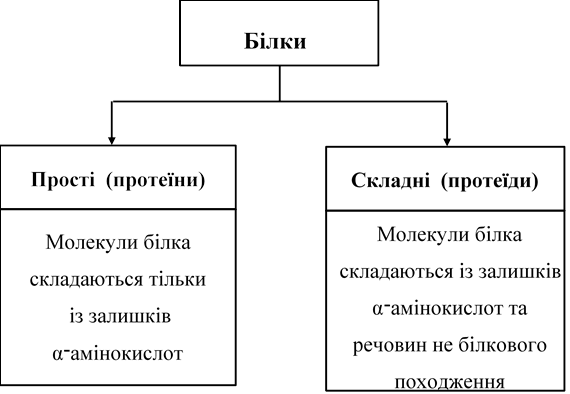
КЛАСИФІКАЦІЯ БІЛКІВ
І. За походженням
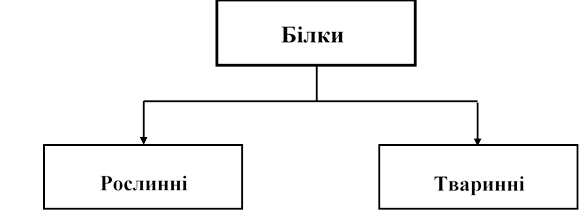
ІІ. За будовою
ОСНОВНІ ВЕЛИЧИНИ ТА ФОРМУЛИ
Величини:
А – атомна маса хімічного елемента, г/моль М – молярна маса речовини, г/моль n – кількість речовини, моль m – маса речовини, г
V – об’єм, л
V0 = 22,4 л/моль; стала
N – кількість атомів хімічного елемента w – масова частка, % або долі ρ - густина речовини, г/мл або г/см3
|
V n V0 |
|
|
|
m V |
|
m w |
|
M 2 ДН2 |
|
|
|
М 32 ДО2 |
|
М 29 Дпов. |
|
N M w A100% |
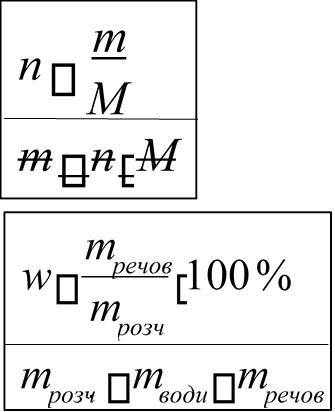 ДН2 (До2, Дпов) – відносна густина пари речовини за воднем (киснем, повітрям) Формули:
ДН2 (До2, Дпов) – відносна густина пари речовини за воднем (киснем, повітрям) Формули:
37
ПРИКЛАДИ РОЗВ'ЯЗУВАННЯ РОЗРАХУНКОВИХ ЗАДАЧ
Середній рівень
Задача №1. Обчисліть масу 0,5 моль сульфатної кислоти H2SO4.
|
m = n · |
 n(H2SO4) = 0,5 моль m(H2SO4) = n(H2SO4) · M(H2SO4) m(H2SO4) – ? M(H2SO4) = 1·2 + 32 + 16·4 = 98 г/моль m(H2SO4) = 0,5моль · 98 г/моль = 49г
n(H2SO4) = 0,5 моль m(H2SO4) = n(H2SO4) · M(H2SO4) m(H2SO4) – ? M(H2SO4) = 1·2 + 32 + 16·4 = 98 г/моль m(H2SO4) = 0,5моль · 98 г/моль = 49г
Відповідь: m(H2SO4) = 49 г
Задача №2. Скільки моль становить 67,2 л вуглекислого газу?
|
nV V0 |
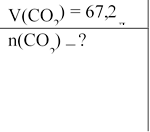
![]() nCO VСO2 V0 = 22,4 л/моль
nCO VСO2 V0 = 22,4 л/моль
2
![]() 67,2л 3мольV0 nCO
67,2л 3мольV0 nCO
2 22,4л/моль
Відповідь: n(C02) = 3 моль
Задача №3.
Увага! В органічній хімії у загальних формулах гомологічних рядів n позначає кількість атомів Карбону.
Молярна маса насиченого вуглеводню дорівнює 44 г/моль. Визначте формулу речовини і назвіть її.
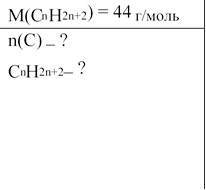 М(СnН2n+2) = 44
М(СnН2n+2) = 44
A(С)·n + А(Н)·(2n+2) = 44
12n + 2n + 2 = 44
14n = 44 – 2 14n = 42
n = 3 С3Н8 – пропан
Відповідь: С3Н8 – пропан
Достатній рівень
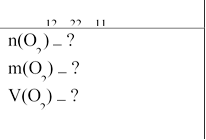
![]() Задача №1. Обчисліть кількість, масу і об'єм кисню, що потрібний для окиснення 3,42 г сахарози. m (С Н О ) = 3,42 г 0,01 моль х моль
Задача №1. Обчисліть кількість, масу і об'єм кисню, що потрібний для окиснення 3,42 г сахарози. m (С Н О ) = 3,42 г 0,01 моль х моль
С12Н22О1112О2 12СО2 11Н2О
1 моль 12моль
n С12Н22О11 mС12Н22О11 ![]() 3,42г 0,01моль MС12Н22О11 342г/ моль
3,42г 0,01моль MС12Н22О11 342г/ моль
М(С12Н22O11) = 12 • 12 + 1 • 22 + 16 • 11 = 342 г/моль
0,01моль хмоль 0,0112
; хмоль 0,12моль; 1моль 12моль 1
n(O2) = 0,12 моль;
|
m = n · |
m(O2) = 0,12 моль • 32 г/моль = 3,84 г
М(O2) = 16 • 2 = 32 г/моль
|
V=n · V0 |
V0 = 22,4 л/моль
V(O2) = 0,12 моль • 22,4 л/моль = 2,688 ≈ 2,7 л.
 Відповідь: n(О2) = 0,12 моль m(O2) = 3,84 г V(O2) = 2,7л
Відповідь: n(О2) = 0,12 моль m(O2) = 3,84 г V(O2) = 2,7л
Задача №2. Масова частка Карбону у вуглеводні дорівнює 92,3%. Густина пари речовини за воднем дорівнює 39. Визначте формулу речовини і назвіть її.
N(C)  w(C)M M2Д2 23978
w(C)M M2Д2 23978
A(C)100%
|
wM N A100% |
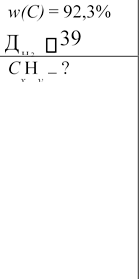 N(C) 9212,3%10078% 6 w(H)M
N(C) 9212,3%10078% 6 w(H)M
N(Н) A(H)100%
w(H) = 100% - w(C) = 100% - 92,3% = 7,7%;
NH 7,7%78 6
1100% С6Н6 – бензол
Відповідь: С6Н6 – бензол.
|
|
Задача №3. Зробіть необхідні обчислення і приготуйте розчин масою 200 г, у якому масова частка натрій хлориду становить 10%. w(NaCl) = 10% wmрозч.
![]() mрозч. = 200 г m(NaCl) – ? m(H20) – ? V(H20) – ?
mрозч. = 200 г m(NaCl) – ? m(H20) – ? V(H20) – ?
mречов. ![]() 100%
100%
![]() w(NaCl100)%mрозч. 10%100200% г 20г m(NaCl)
w(NaCl100)%mрозч. 10%100200% г 20г m(NaCl)
m(H2O)= mрозч.- m(NaCl) = 200г - 20г = 180г
![]()
![]() m(H2O) ρ(H2O)=1г/мл; V(H2O) 180г 180мл
m(H2O) ρ(H2O)=1г/мл; V(H2O) 180г 180мл
V(H2O)
ρ(H2O) 1г/мл
Відповідь: m(NaCl)=20г
V(H2O)=180мл
39
ВІДНОСНІ МОЛЯРНІ МАСИ ДЕЯКИХ НЕОРГАНІЧНИХ РЕЧОВИН
|
А н і о н и |
|
К а т і о н и |
|||||||||||||||
|
H+ |
NH4+ |
K+ |
Na+ |
Ag+ |
Ba2+ |
Ca2+ |
Mg2+ |
Zn2+ |
Mn2+ |
Cu2+ |
Pb2+ |
Hg2+ |
Fe2+ |
Fe3+ |
Al3+ |
Cr3+ |
|
|
2- О |
18 |
– |
94 |
62 |
232 |
153 |
56 |
40 |
81 |
71 |
80 |
223 |
217 |
72 |
160 |
102 |
152 |
|
OH- |
18 |
35 |
56 |
40 |
– |
171 |
74 |
58 |
99 |
89 |
98 |
241 |
– |
90 |
107 |
78 |
103 |
|
Cl- |
36,5 |
53,5 |
74,5 |
58,5 |
143,5 |
208 |
111 |
95 |
136 |
126 |
135 |
278 |
272 |
127 |
162,5 |
133,5 |
158,5 |
|
Br- |
81 |
98 |
119 |
103 |
188 |
297 |
200 |
184 |
225 |
215 |
224 |
367 |
361 |
216 |
296 |
267 |
292 |
|
I- |
128 |
145 |
166 |
150 |
235 |
391 |
294 |
278 |
319 |
309 |
– |
461 |
455 |
310 |
– |
408 |
433 |
|
S2- |
34 |
68 |
110 |
78 |
248 |
169 |
72 |
56 |
97 |
87 |
96 |
239 |
233 |
88 |
208 |
150 |
200 |
|
- NO3 |
63 |
80 |
101 |
85 |
170 |
261 |
164 |
148 |
189 |
179 |
188 |
331 |
325 |
180 |
242 |
213 |
238 |
|
SO32- |
82 |
116 |
158 |
126 |
296 |
217 |
120 |
104 |
145 |
135 |
– |
287 |
281 |
136 |
– |
– |
– |
|
SO42- |
98 |
132 |
174 |
142 |
312 |
233 |
136 |
120 |
161 |
151 |
160 |
303 |
297 |
152 |
400 |
342 |
392 |
|
СO32- |
62 |
96 |
138 |
106 |
276 |
197 |
100 |
84 |
125 |
115 |
124 |
267 |
– |
116 |
– |
– |
– |
|
SiO32- |
78 |
112 |
154 |
122 |
292 |
213 |
116 |
100 |
141 |
131 |
140 |
283 |
277 |
132 |
– |
– |
– |
|
PO43- |
98 |
149 |
212 |
164 |
419 |
601 |
310 |
262 |
385 |
355 |
382 |
811 |
793 |
358 |
151 |
122 |
147 |
|
CH3COO- |
60 |
77 |
98 |
82 |
167 |
255 |
158 |
142 |
183 |
173 |
182 |
325 |
319 |
174 |
– |
204 |
229 |
НАДАННЯ НАЗВ РОЗГАЛУЖЕНИМ ОРГАНІЧНИМ РЕЧОВИНАМ ЗА МІЖНАРОДНОЮ НОМЕНКЛАТУРОЮ
І. ПРАВИЛО НАДАННЯ НАЗВ РОЗГАЛУЖЕНИМ НАСИЧЕНИМ ВУГЛЕВОДНЯМ:
1. Обрати головний (найдовший) карбоновий ланцюг.
2. Пронумерувати його починаючи з того боку, де ближче і більше відгалужень.
3. Визначити бічні відгалуження (радикали) та номера Карбонів, яким вони належать.
Радикали: СН3 – метил С2Н5 – етил
С3Н7 – пропіл
Вr – бромо
СІ – хлоро
NO2 – нітро
4. В алфавітному порядку перелічити відгалуження, вказуючи номер Карбону якому вони належать і, якщо треба, множинні префікси (ди-, три-, тетра-) і додати назву головного ланцюга, що відповідає назві нормального алкану з тим самим числом атомів Карбону.
Наприклад: CH3 Вr
׀ 1 2 3 ׀ 4 5 6
CH3 – CH – CH – CH2 – CH2 – CH2
׀ 1,5- дибромо – 4 – метилгексан
Вr
II.ПРАВИЛО НАДАННЯ НАЗВ РОЗГАЛУЖЕНИМ НЕНАСИЧЕНИМ ВУГЛЕВОДНЯМ:
Назву розгалуженим ненасиченим вуглеводням надають так само, як і алканам, тільки при нумерації головного ланцюга перевагу надають ненасиченому зв'язку, після назви ланцюга вказують найменший номер Карбону, якому належить кратний зв'язок, потім додають закінчення -ен або -ин (-ін) залежно від типу кратного зв’язку.
Наприклад: 1) 1 2 3 4
CH2 = CH – CH – CH2
׀ 3 – метилбут – 1 – ен CH3
5 4 3 2 1
2) CH3 – CH – C ≡ C – CH3
׀
Br 4 – бромопент – 2 – ин
III. ПРАВИЛО НАДАННЯ НАЗВ РОЗГАЛУЖЕНИМ АЛКАНОЛАМ
Назву розгалуженим алканолам надають так само, як і розгалуженим алканам, тільки при нумерації карбонового ланцюга, перевагу надають функціональній спиртовій групі і перед назвою головного ланцюга вказують номер Карбону, якому належить група ОН і наприкінці назви додають суфікс -ол.
Наприклад: CH3
1CH 2 –2 CH2 –3 CH2 –4 CH ׀ – CH5 2
׀ ׀
ОН Вr 5 – бромо – 4 метилпентан – 1 – ол
ЗМІСТ
1. Періодична система хімічних елементів Д.І. Менделєєва ................................ 4
2. Назви та символи деяких хімічних елементів .................................................... 5
3. Валентність та ступені окиснення деяких металів і неметалів ........................ 6
4. Характеристика хімічного елемента за ПС ....................................................... 7
5. Характеристика хімічного елемента № 3 за ПС (приклад) .............................. 8
6. Характеристика хімічного елемента № 17 за ПС (приклад) ............................ 9
7. Схема позначення графічної електронної формули .......................................... 10
8. Приклади електронної конфігурації атомів хімічних елементів ..................... 10
9. Типи хімічних зв'язків та їх ознаки ..................................................................... 12
10. Приклади хімічного зв'язку .................................................................................. 13
11. Характеристика молекули речовини ................................................................... 15 12. Електрохімічний ряд напруги металів ................................................................ 16
13. Таблиця електронегативності неметалів ............................................................ 16
14. Схема складання формул речовин ...................................................................... 17
15. Склад молекул основних класів неорганічних речовин .................................. 18
16. Класифікація неорганічних речовин ................................................................... 19
17. Розчинність кислот, основ та солей у воді ......................................................... 20
18. Таблиця катіонів та аніонів .................................................................................. 21
19. Таблиця деяких неметалів та їх відповідних сполук ......................................... 22
20. Таблиця деяких металів та їх відповідних сполук ............................................. 24
21. Хімічні властивості основних класів неорганічних речовин ........................... 26 22.Основні класи органічних речовин ..................................................................... 28
23. Таблиця вуглеводнів ............................................................................................. 31
24. Класифікація вуглеводів ....................................................................................... 32
25. Будова молекул глюкози ...................................................................................... 33
26. Класифікація жирів ............................................................................................... 34
27. Класифікація білків ............................................................................................... 35
28. Основні величини та формули ............................................................................. 36
29. Приклади розв'язування розрахункових задач ................................................... 37
30. Відносні молярні маси деяких неорганічних речовин ...................................... 39
31. Надання назв розгалуженим органічним речовинам за міжнародною
номенклатурою ...................................................................................................... 40
ВИКОРИСТАНА ЛІТЕРАТУРА
1. Періодична система хімічних елементів Д.І. Менделєєва.
2. Електрохімічний ряд напруги металів.
3. Базелюк І.І., Величко Л.П., Титаренко Н.В.Довідкові матеріали з хімії.
– К.: ІРПІНЬ, 1998, с. 240.
4. Зеленєва О.Г. Хімія 8-11 клас: Довідник школяра і студента. Донецьк:
ТОВ ВКФ «БАО», 2006, с. 560.
-
Дякую
-


про публікацію авторської розробки
Додати розробку

