Презентація на тему: "Вищі карбонові кислоти: стеаринова, пальмітинова, олеїнова. Мило, його склад, мийна дія"
Про матеріал
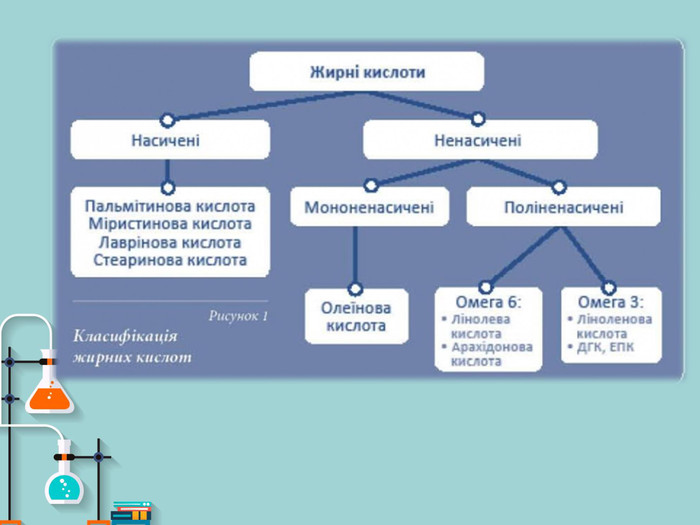
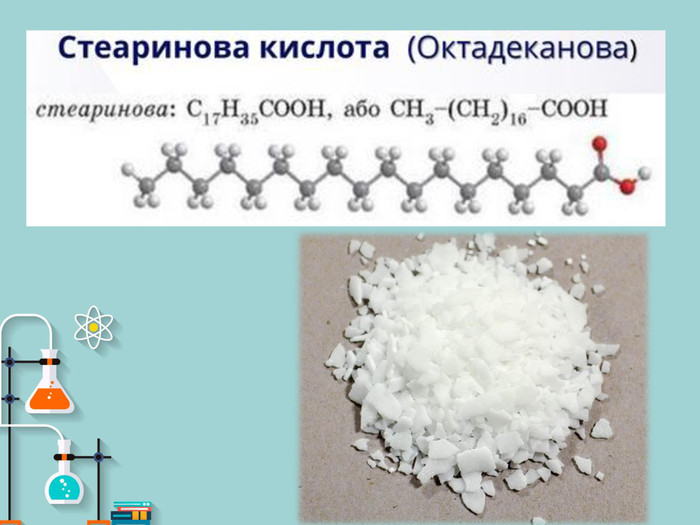
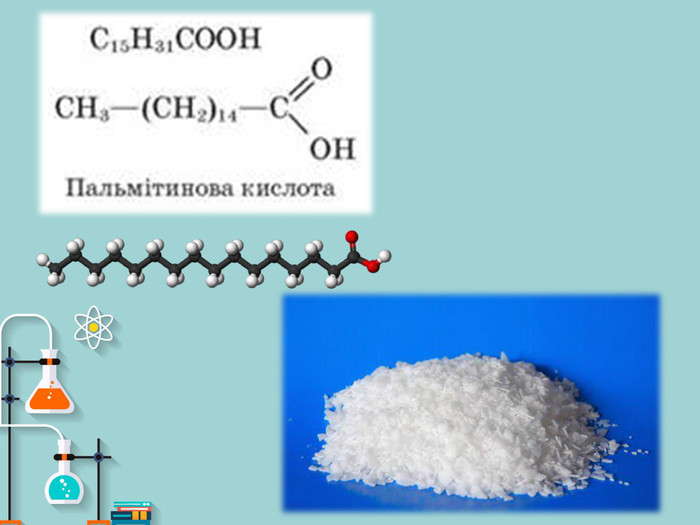
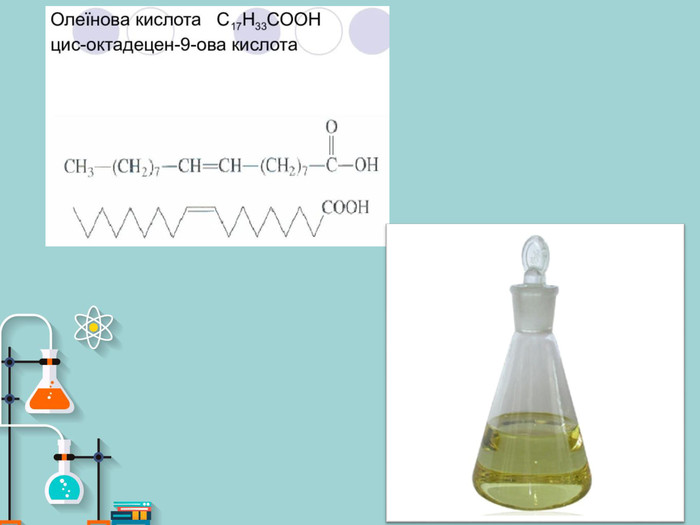
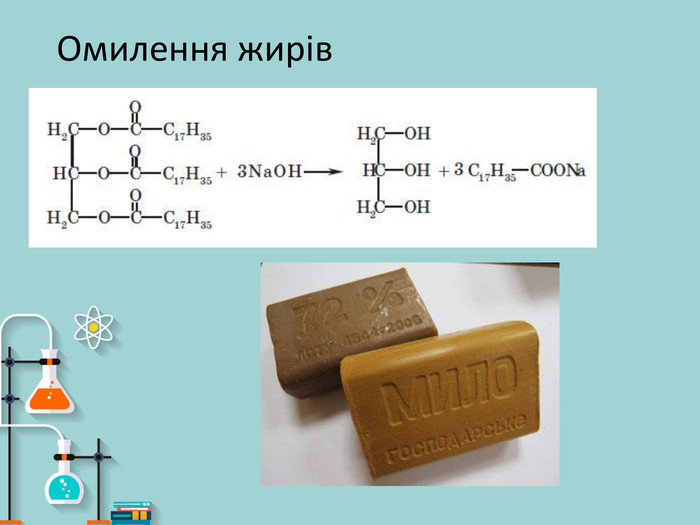
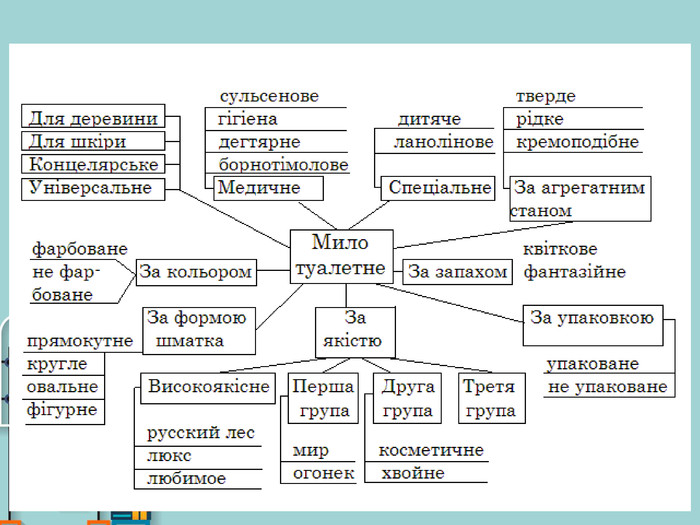
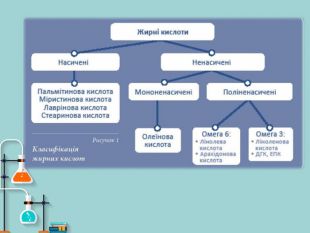
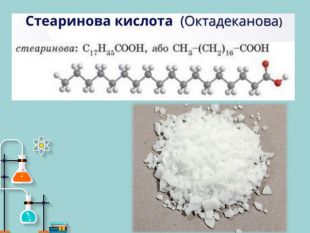
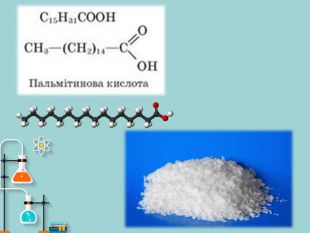
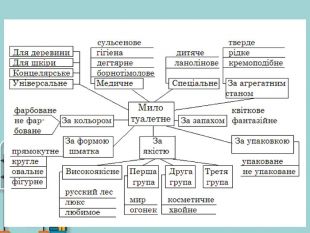
Презентація на тему: "Вищі карбонові кислоти: стеаринова, пальмітинова, олеїнова. Мило, його склад, мийна дія". У презентації зібраний короткий огляд загальної характеристики ВКК, хімічних властивостей ВКК. Також поданий матеріал про стеаринову, пальмітинову та олеїнову кислоти їх фізичні властивості, місткість у природі, використання. Окрім того в презентації подано матеріал про мило, його склад та мийну дію. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дякую!
-
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку