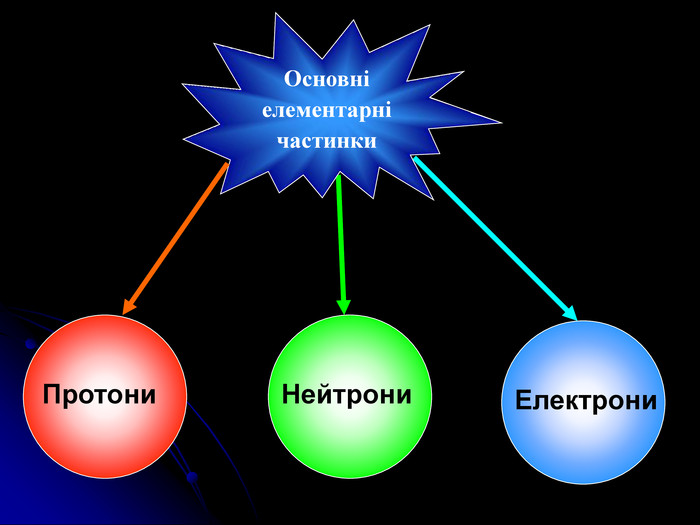
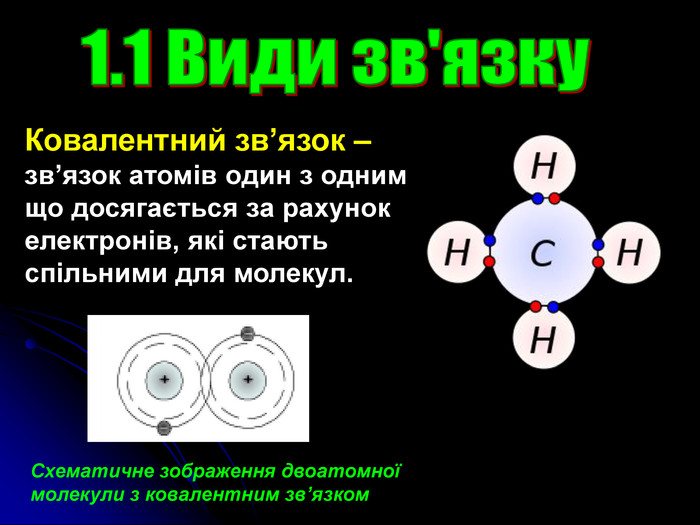
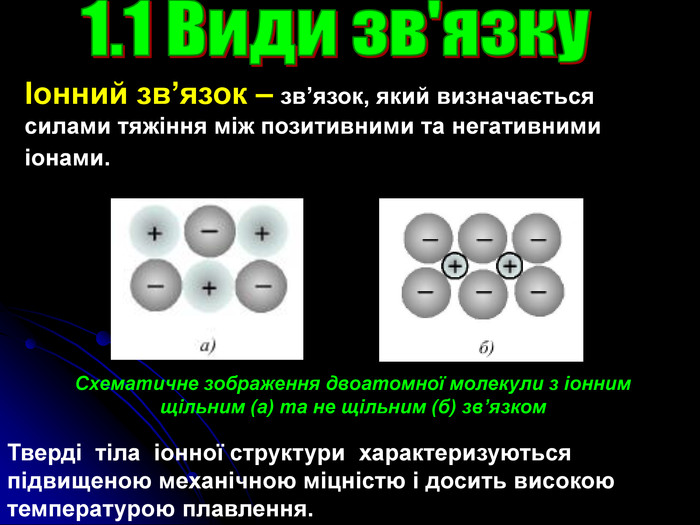
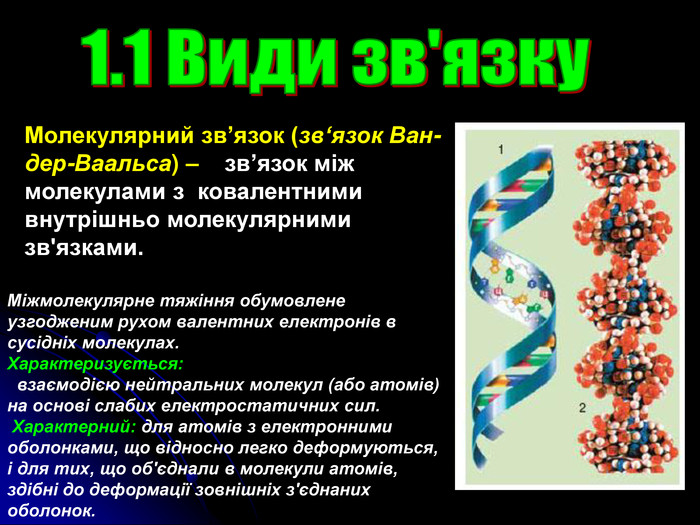
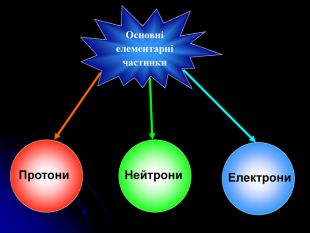
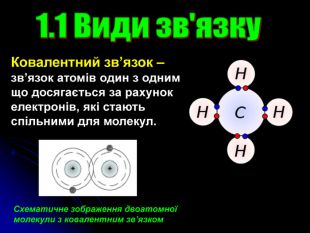
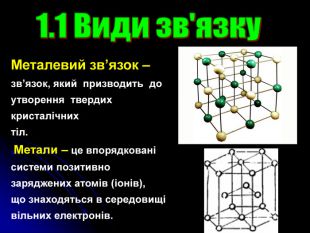
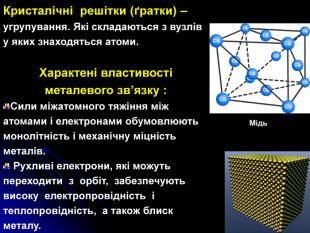
Презентація на тему: "Загальні відомості про будову речовини"
Про матеріал
Презентація на тему: "Загальні відомості про будову речовини". В даній роботі розповідається про моделі атома, види звязку, будову та дефекти твердих тіл, класифікацію речовин по електричних властивостях, класифікацію речовин по магнітним властивостям.
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку