Презентація на тему "Залізо: фізичні та хімічні властивості"
Про матеріал
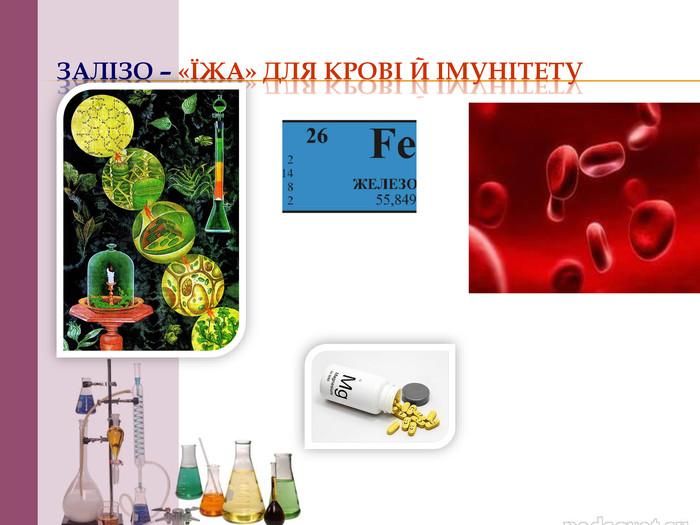
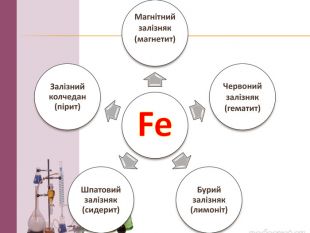
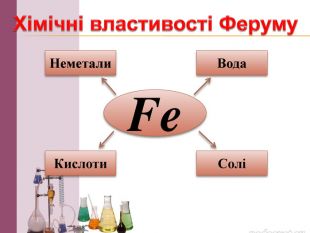
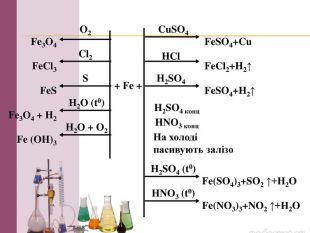
Презентація на тему: "Залізо: фізичні та хімічні властивості". В даному матеріалі розкрито властивості, застосування та біологічна роль Заліза. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
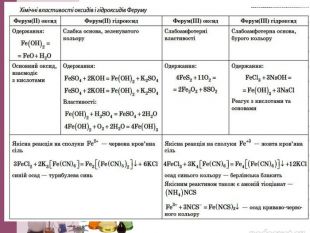
Чомусь поморочила голову, поки відкрила скачану презентацію. Помічаю, що вчителі-колеги часто змішують поняття "хімічний елемент" та "проста речовина". Сполуки Феруму, а не заліза (бо залізо - це проста речовина). Біологічна роль : також застосовуємо поняття "Ферум", а не залізо. До складу сполук входять атоми елемента. Залізо - проста речовина , утворена атомами даного елемента. У елемента з порядковим номером 26 назви простої речовини та елемента не співпадають, Раніше у початкових хімічних поняттях навчали учнів розрізняти коли йдеться про елемент, а коли про речовини (тому що назва була одна). За сучасною номенклатурою ці поняття розділили і навіть в таблицю внесли дві назви (елемент і його проста речовина), щоб не плутали. "Ріжуть слух" такі помилки і не мають логіки. Погодьтеся.
-
-
Дякую щиро! Чудова презентація! Методично грамотно підібраний матеріал. Цікавий, викликає інтерес до вивчення теми в учнів.


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку