Презентація «Ненасичені вуглеводні» 9 клас
| Презентація допоможе провести урок на тему «Етен (етилен) і етин (ацетилен) як представники ненасичених вуглеводнів. Молекулярні і структурні формули. Хімічні властивості» |




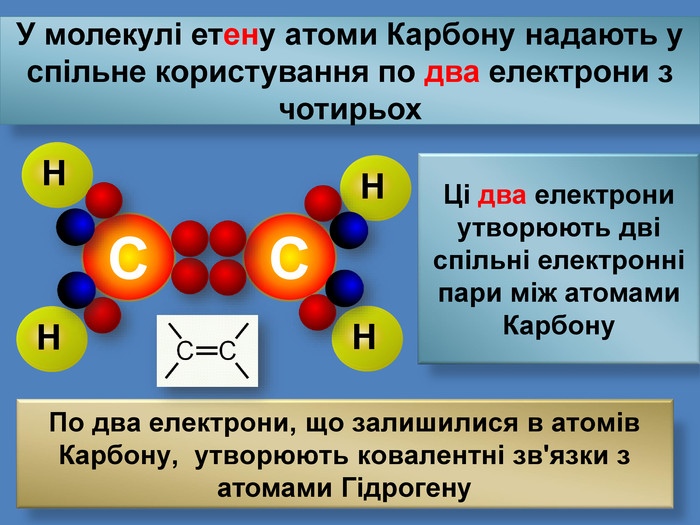








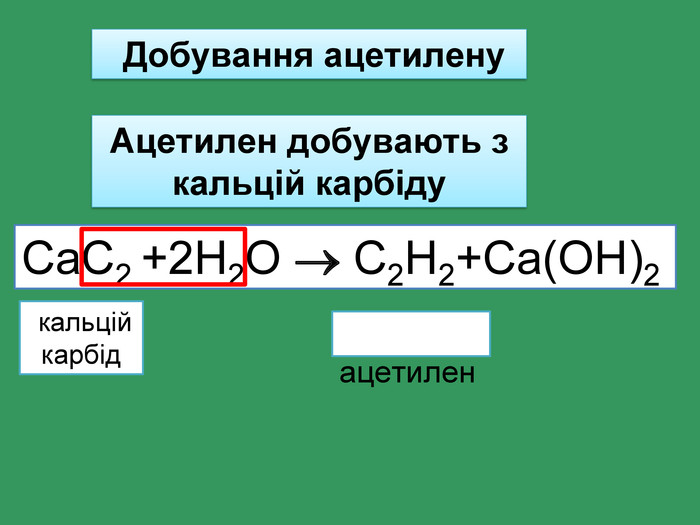
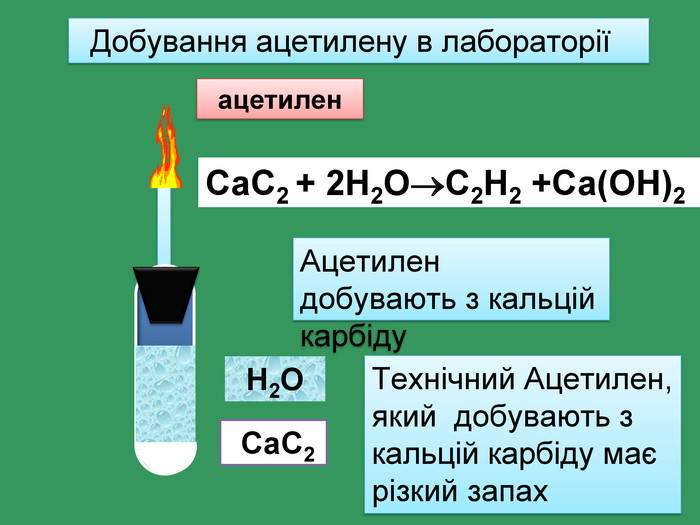
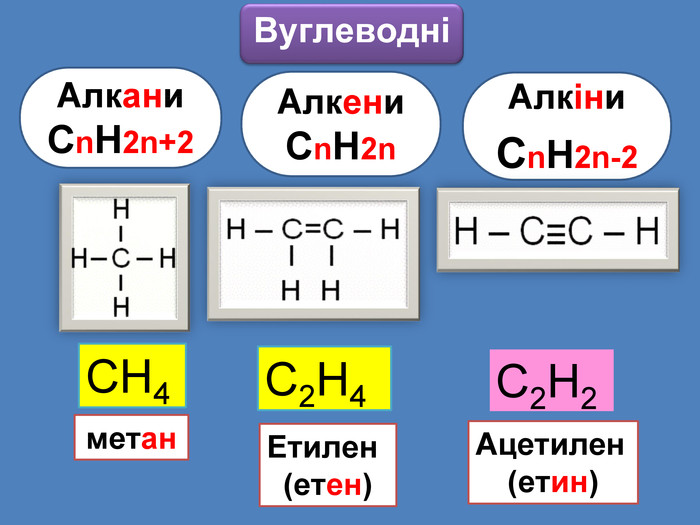


Найпростіші органічні речовин ̶ вуглеводні, які складаються з атомів тільки двох елементів: Карбону і Гідрогену H С У молекулах алканів атоми Карбону зв’язані між собою одинарними зв'язками, а всі інші валентності насичені атомами Гідрогену Ненасичені вуглеводні ̶ це органічні сполуки, в яких не всі валентні електрони атома Карбону утворюють ковалентні зв'язки з атомами Гідрогену
Родоначальником гомологічного ряду алкенів вважають етен С2 Н4, іноді цей ряд так і називають гомологічний ряд етену (етилену)С2 Н4 С3 Н6 С4 Н8 Сn. Н2nетенпропенбутенпентенгексен •••Етиленові вуглеводні Назви етиленових (алкенів) вуглеводнів за міжнародною номенклатурою створюють від назви насичених вуглеводнів, заміняючи закінчення АН на ЕН(ще їх називають олефіни)Загальна формула
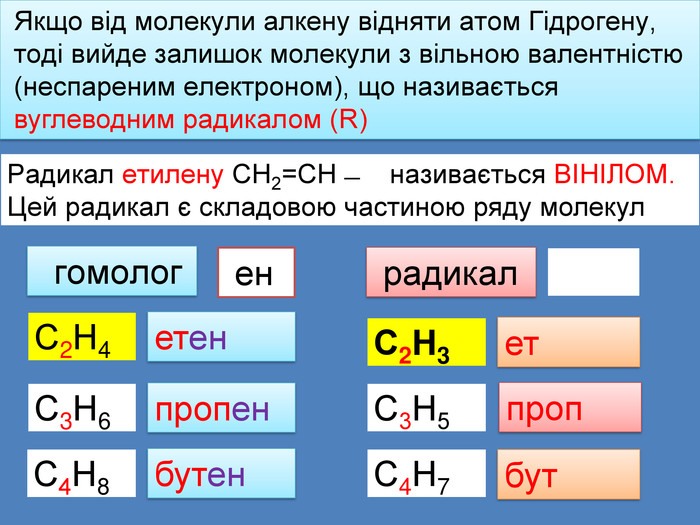
Якщо від молекули алкену відняти атом Гідрогену, тоді вийде залишок молекули з вільною валентністю (неспареним електроном), що називається вуглеводним радикалом (R)Радикал етилену СН2=СН ̶ називається ВІНІЛОМ. Цей радикал є складовою частиною ряду молекул радикал етенпропенбутен. С2 Н4 С3 Н6 С4 Н8 гомолог С2 Н3ет. С3 Н5проп. С4 Н7бут ен
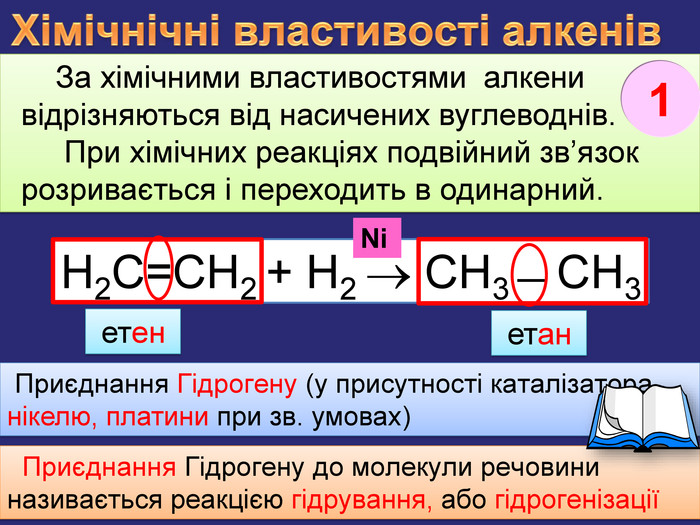
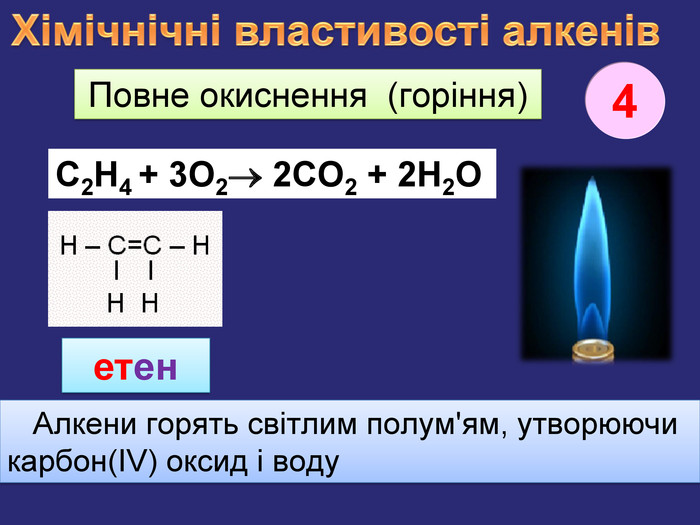
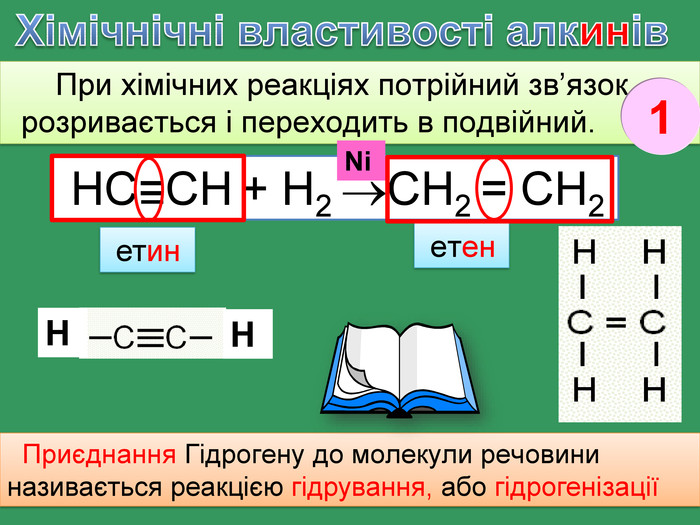
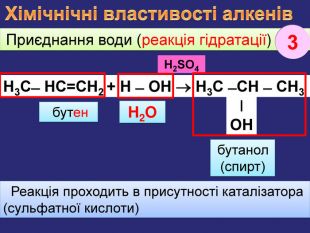
Хімічнічні властивості алкенів. За хімічними властивостями алкени відрізняються від насичених вуглеводнів. При хімічних реакціях подвійний зв’язок розривається і переходить в одинарний. Приєднання Гідрогену (у присутності каталізатора нікелю, платини при зв. умовах) етан Приєднання Гідрогену до молекули речовини називається реакцією гідрування, або гідрогенізаціїН2 С=СН2 + Н2 СН3 ̶ СН3 етен. Ni1rr
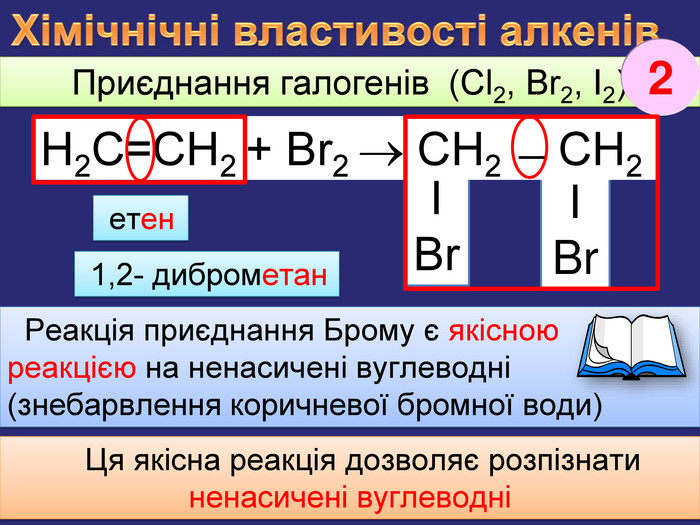
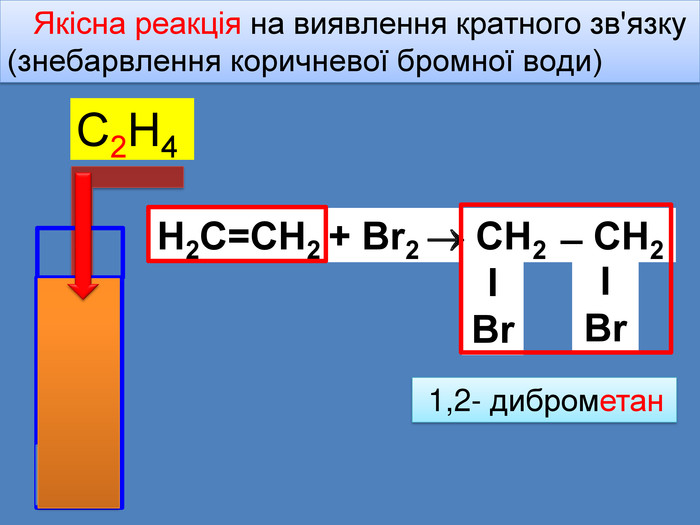
ΙBrΙBr. Хімічнічні властивості алкенів Приєднання галогенів (Cl2, Br2, I2) Реакція приєднання Брому є якісною реакцією на ненасичені вуглеводні(знебарвлення коричневої бромної води) Ця якісна реакція дозволяє розпізнати ненасичені вуглеводніН2 С=СН2 + Br2 СН2 ̶ СН2 етен2 1,2- диброметанrr
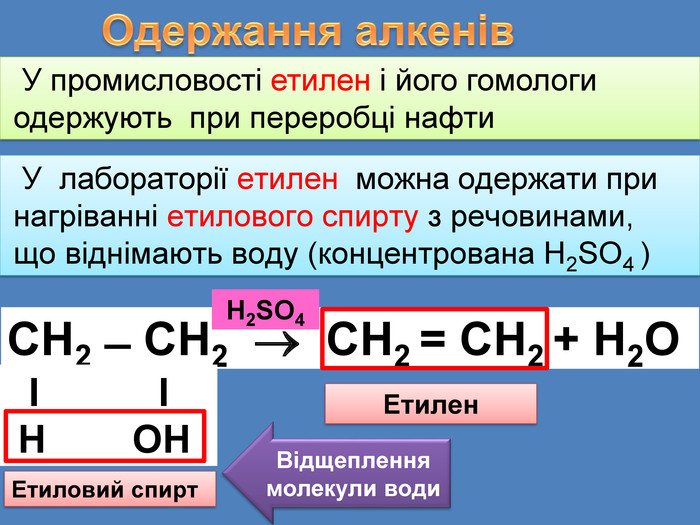
Одержання алкенів У промисловості етилен і його гомологи одержують при переробці нафти У лабораторії етилен можна одержати при нагріванні етилового спирту з речовинами, що віднімають воду (концентрована Н2 SО4 )СН2 ̶ СН2 СН2 = СН2 + Н2 О Н2 SO4 Ι Ι Н ОНЕтиловий спирт. Етилен. Відщеплення молекули води
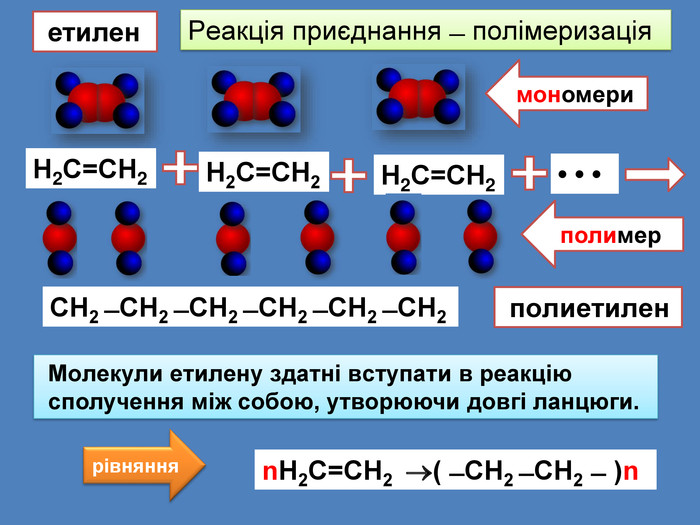
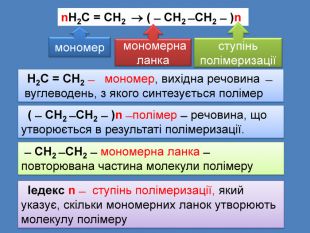
Н2 С = СН2 ̶ мономер, вихідна речовина ̶ вуглеводень, з якого синтезується полімер ( ̶ СН2 ̶ СН2 ̶ )n ̶ полімер ̶ речовина, що утворюється в результаті полімеризації. ̶ СН2 ̶ СН2 ̶ мономерна ланка ̶ повторювана частина молекули полімеру Іедекс n ̶ ступінь полімеризації, який указує, скільки мономерних ланок утворюють молекулу полімеруn. Н2 С = СН2 ( ̶ СН2 ̶ СН2 ̶ )n мономер мономерна ланкаступінь полімеризації
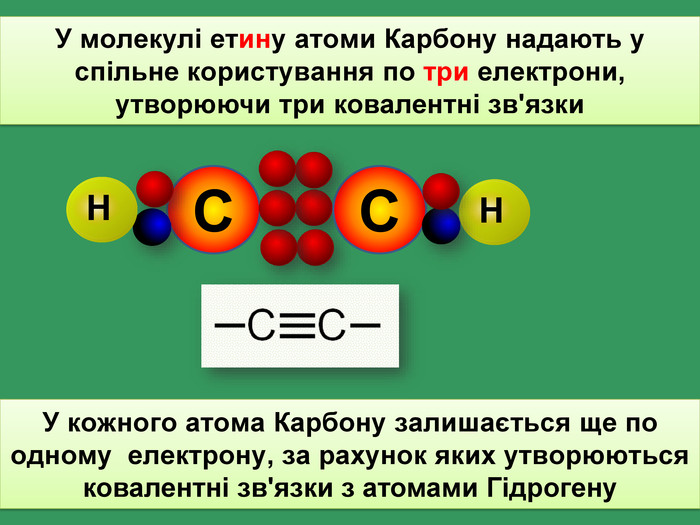
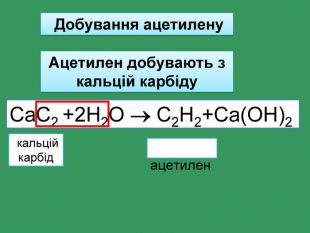
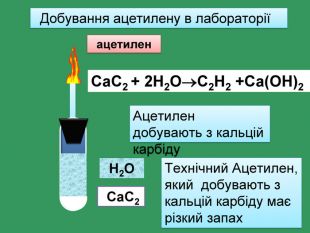
Родоначальником гомологічного ряду алкинів вважають етин С2 Н2, іноді цей ряд так і називають гомологічний ряд етину (ацетилену)С2 Н2 С3 Н3 С4 Н4 Сn. Н2n-2етинпропинбутинпентингексин •••Ацетиленові вуглеводні Ацетиленові вуглеводні (алкіни) ̶ це вуглеводні, у молекулах яких містяться вуглеводні атоми, що мають потрійний зв'язок. Загальна формула
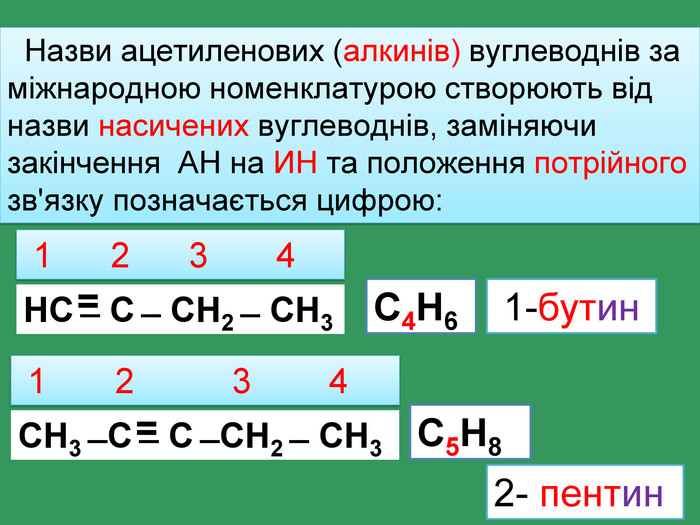
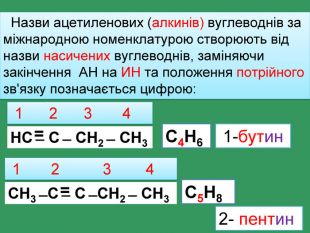
НС ̶ С ̶ СН2 ̶ СН32- пентин 1 2 3 4 С4 Н6 СН3 ̶ С ̶ С ̶ СН2 ̶ СН3 1 2 3 4 С5 Н81-бутин Назви ацетиленових (алкинів) вуглеводнів за міжнародною номенклатурою створюють від назви насичених вуглеводнів, заміняючи закінчення АН на ИН та положення потрійного зв'язку позначається цифрою:==
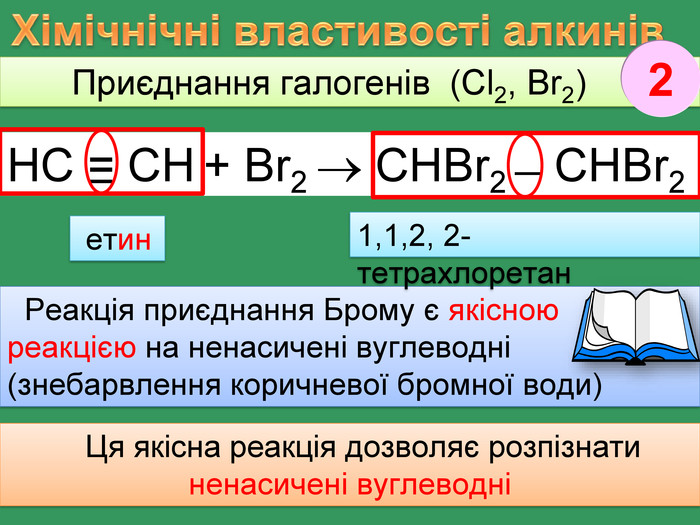
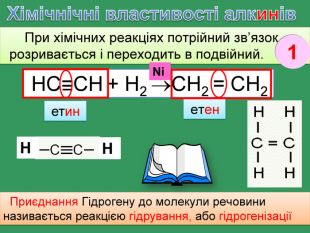
Хімічнічні властивості алкинів Приєднання галогенів (Cl2, Br2) Реакція приєднання Брому є якісною реакцією на ненасичені вуглеводні(знебарвлення коричневої бромної води)1,1,2, 2- тетрахлоретан Ця якісна реакція дозволяє розпізнати ненасичені вуглеводніНС = СН + Br2 СНBr2 ̶ СНBr2 етин2̶rr
Джерела. Григорович О. В. Хімія: підруч. для 9 класу загальноосвіт. навч.закл./ О. В. Григорович .̶ Харків: Вид-во «Ранок», 2017 Шаповалов С. А. Хімія. Довідник старшокласника та абітурієнта. Харків. Торсінг, 2005. Данильченко В.Є Халімон Є. В. Хімія. Навчальний посібник. 8-9 класи – Харків.: Країна мрій, 2008. – 128с.


про публікацію авторської розробки
Додати розробку























-

Воропай Світлана Василівна
17.02.2025 в 23:31
Роботи прикладено багато, але, на жаль, хімічних помилок багато....
Загальна:
3.0
Структурованість
4.0
Оригінальність викладу
3.0
Відповідність темі
2.0
-

Козарик Віктор Богданович
01.12.2023 в 11:26
Дякую. Коротко і зрозуміло, презентація добре структурована
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Товстолес Лариса
01.02.2023 в 20:02
Дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Безсонова Оксана
24.01.2023 в 16:41
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Безсонова Оксана
24.01.2023 в 16:41
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Воронівська Наталья Гуріївна
17.01.2023 в 13:29
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Дзевенко Марія Віталіївна
01.02.2022 в 14:29
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Мельничук Олена Василівна
27.01.2022 в 18:13
Дякую)
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Шабуніна Оксана
24.01.2022 в 17:54
Загальна:
4.3
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
4.0
-

Пишна Наталія
24.01.2022 в 12:45
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Кобзар Оксана Іванівна
05.04.2021 в 14:21
дякую!!!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Радченко Тетяна Василівна
16.02.2021 в 19:54
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Тихончук Олександр Васильович
19.02.2020 в 06:11
Презентація дійсно чудова - інформативна, прекрасний дизайн. Але на жаль є помилки, які бажано було б виправити.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Евсеєнко Інна Геннадіївна
02.02.2020 в 17:53
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Паращак Наталія Миколаївна
28.03.2018 в 12:00
допоможе при проведенні уроків у 9 класі по темі алкени та алкіни
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Виноградова Людмила Анатоліївна
28.02.2018 в 17:28
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Клапків Оксана
26.02.2018 в 22:02
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Кукса Наталія Миколаївна
13.02.2018 в 15:12
Дуже змістовна,яскрава презентація. Дякую.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Шпильова Вікторія Володимирівна
13.02.2018 в 12:38
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 16 відгуків