Презентація:"Окисно-відновні реакції"
Про матеріал
Презентація допоможе сформувати знання про окисно-відновні реакції,
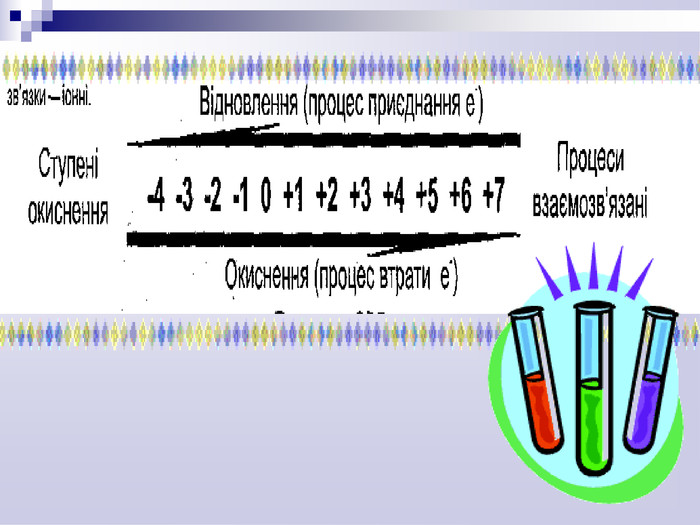
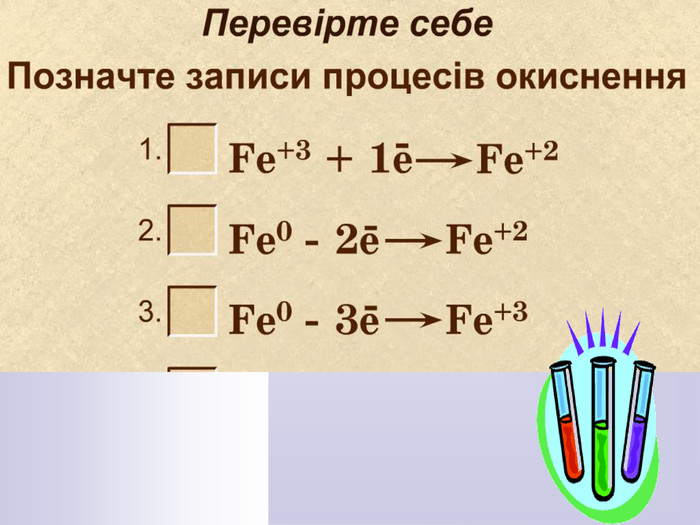
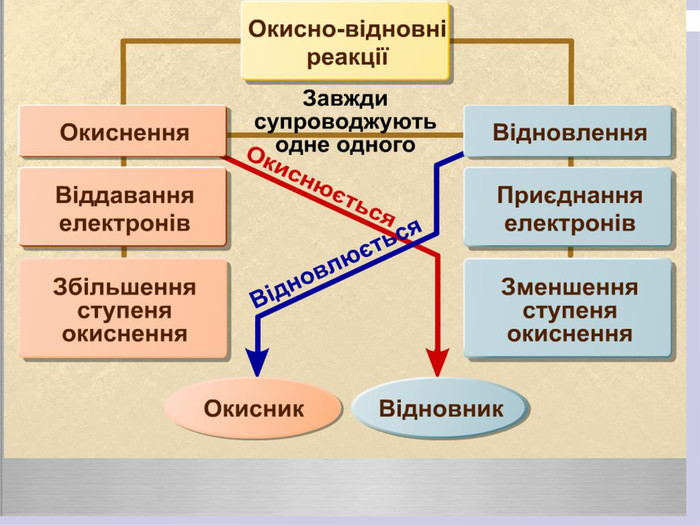
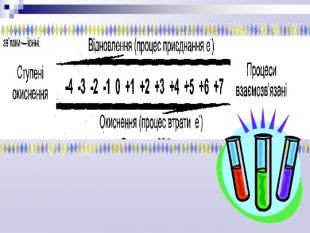
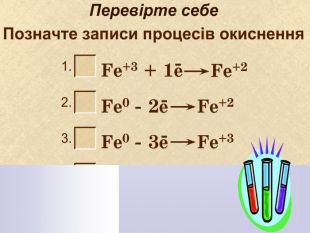
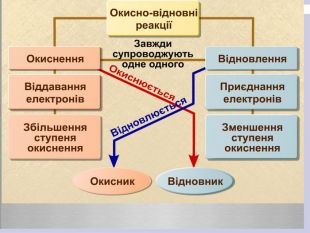
про процеси окиснення, відновлення,
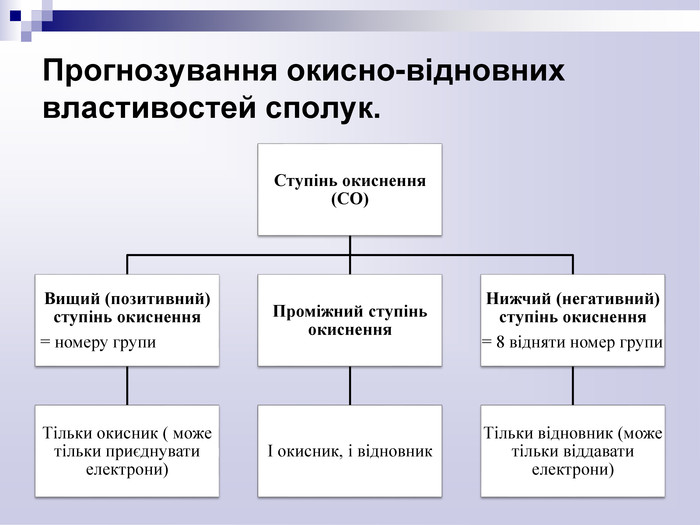
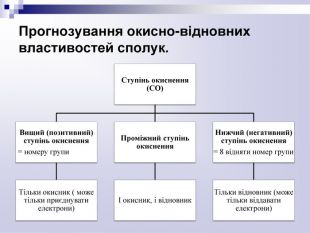
навчить розрізняти які з речовин є окисниками, а які відновниками
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку

















































-

Смакоуз Тамара Василівна
28.11.2022 в 18:26
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

фертак наталя
28.11.2021 в 13:46
Дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Дробот Олена Геннадіївна
10.11.2021 в 11:05
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Крсек Алла Геннадіївна
12.12.2019 в 21:27
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Скряга Наталя Миколаївна
25.11.2019 в 14:43
Чудова презентація! Продумано все, дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 2 відгука