Презентація Окисно-відновні реакції
Про матеріал
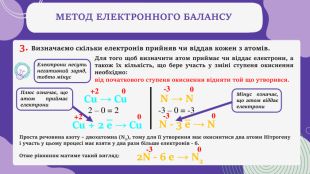
У поданій презентації зрозуміло викладено поняття про окисно-відновні реакції, процеси окиснення та відновлення, окисники та відновники, а також метод електронного балансу окисно-відновної реакції. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку