Презентація "Окисно-відновні реакції навколо нас"









![Виробництво нітратної (азотної) кислоти. Азотну кислоту отримують шляхом реакції діоксиду азоту (NO2) з водою. Як правило, монооксид азоту, який утворюється в результаті реакції, знову окиснюється киснем повітря та може бути використаний для отримання додаткового діоксиду азоту. Майже чиста азотна кислота може бути отримана шляхом реакції сірчаної кислоти з натрієвою селітрою:2 Na. NO3+H2 SO4 2 HNO3 + Na2 SO4 У сучасній хімічній промисловості нітратну кислоту добувають шляхом каталітичного окиснення аміаку до монооксиду азоту з наступним окисненням NO киснем [повітря] при 700-900 °C до діоксиду азоту і поглинанням останнього водою. Каталізатор - платинова сітка. Виробництво нітратної (азотної) кислоти. Азотну кислоту отримують шляхом реакції діоксиду азоту (NO2) з водою. Як правило, монооксид азоту, який утворюється в результаті реакції, знову окиснюється киснем повітря та може бути використаний для отримання додаткового діоксиду азоту. Майже чиста азотна кислота може бути отримана шляхом реакції сірчаної кислоти з натрієвою селітрою:2 Na. NO3+H2 SO4 2 HNO3 + Na2 SO4 У сучасній хімічній промисловості нітратну кислоту добувають шляхом каталітичного окиснення аміаку до монооксиду азоту з наступним окисненням NO киснем [повітря] при 700-900 °C до діоксиду азоту і поглинанням останнього водою. Каталізатор - платинова сітка.](/uploads/files/914048/228816/244772_images/10.jpg)














У процесі окисно-відновної реакції відновник віддає електрони, тобто окиснюється; окисник приєднує електрони, тобто відновлюється. Причому будь-яка окисно-відновна реакція являє собою єдність двох протилежних перетворень — окиснення та відновлення, що відбуваються одночасно та без відриву одне від одного. А А+ + е– Окиснення: речовина А як відновник віддає один електрон. В + е– В–Відновлення: Речовина В як окисник приймає електрон. А + В А+ + В–Окисно-відновна реакція: Речовина А віддає електрон речовині В.
2. Окисно-відновні реакції, що відбуваються в природіВулкан - геологічне утворення, яке виникає над каналами та тріщинами у земній корі, якими на поверхню викидаються лава, попіл, гарячі гази, водяна пара й уламки гірських порід. Вулкани зазвичай мають конусоподібну форму з кратером — лійкоподібним заглибленням на вершині. Виверження деяких вулканів, наприклад, Стромболі і Везувію в Італії, проходить із вибухом, несучи великі руйнування, інші, наприклад, на Гаваях, «тихі»: лава просто піднімається по кратеру та переливається через край. Всього на Землі відомо 1343 діючих вулканів. На думку деяких дослідників найбільшим вулканом Землі є Єллоустонський. Цей вулкан належить до згаслих. Його останнє потужне виверження відбулося 600 тис. років тому. Але за останні 100 років зафіксовано підняття центру кальдери цього вулкана на 8 м, що свідчить про збільшення внутрішнього тиску.
Під час виверження вулкани викидають у атмосферу гази, склад яких значно змінюється від одного вулкана до іншого. Зазвичай основним вулканічним газом є водяна пара. Іншими типовими складовими є вуглекислий газ та двоокис сірки.Інші важливі домішки — сірководень, хлорид водню та фторид водню. У меншій кількості вулкани викидають чадний газ, галокарбони, органічні сполуки й хлориди металів. При потужних виверженнях вулканічні гази, попіл викидаються у стратосферу на висоту 16-20 км. Найважливішим наслідком цього є перетворення двоокису сірки в сірчану кислоту (H2 SO4), яка швидко конденсується, утворюючи сірчані аерозолі. Аерозолі збільшують альбедо Землі. Відбиття сонячної радіації в космос понижує температуру нижніх шарів атмосфери - тропосфери. Водночас, вони затримують теплове випромінювання Землі, нагріваючи стратосферу.
Гроза - атмосферне явище, пов'язане з електричними розрядами в купчасто-дощових хмарах. Супроводжується блискавкою та громом. Гроза відноситься до одних з найнебезпечніших для людини природних явищ. Блискавка - електричний розряд між хмарами або між хмарою та землею. У процесі утворення опадів у хмарі відбувається електризація крапель або льодяних частинок. Унаслідок сильних висхідних потоків повітря в хмарі утворюються відокремлені області, заряджені різнойменними зарядами. Коли напруженість електричного поля у хмарі або між нижньою зарядженою областю і землею досягає пробійного значення, виникає блискавка.
Під час грози відбувається окисно-відновна реакція: зв’язування атмосферного азоту: N2 + O2 → NONO + O2 NO2 Одночасно на Землі діє близько 1,5 тис. гроз, середня інтенсивність розрядів оцінюється в 46 блискавок на секунду. У полярних районах Арктики, Антарктики, над полюсами гроз практично не буває.
Окисно-відновні реакції, що відбуваються в промисловостіНітратна (азотна) кислота HNO3 - сильна одноосновна кислота. Висококорозійна, реагує з більшістю металів, сильний окисник. Має тенденцію набувати жовтого відтінку через накопичення оксидів азоту, при довгому зберіганні. Зазвичай азотна кислота має концентрацію 68 %. Якщо ж концентрація перевищує 86 %, то вона називається димною кислотою. В залежності від кольору «диму» концентрована кислота поділяється на білу та червону в концентрації, більшій за 95 %.
Виробництво нітратної (азотної) кислоти. Азотну кислоту отримують шляхом реакції діоксиду азоту (NO2) з водою. Як правило, монооксид азоту, який утворюється в результаті реакції, знову окиснюється киснем повітря та може бути використаний для отримання додаткового діоксиду азоту. Майже чиста азотна кислота може бути отримана шляхом реакції сірчаної кислоти з натрієвою селітрою:2 Na. NO3+H2 SO4 2 HNO3 + Na2 SO4 У сучасній хімічній промисловості нітратну кислоту добувають шляхом каталітичного окиснення аміаку до монооксиду азоту з наступним окисненням NO киснем [повітря] при 700-900 °C до діоксиду азоту і поглинанням останнього водою. Каталізатор - платинова сітка.
Нітратна кислота є одним з найважливіших продуктів хімічної промисловості. Вона виробляється у дуже великих кількостях, використовується для виробництва азотних добрив, у кольоровій металургії для розділення металів, а також хімічній промисловості для виробництва пластмас, вибухових речовин, целулоїду і фотокіноплівки, штучного волокна, органічних барвників, лікувальних речовин тощо.
Аміак (амоніак) NH3 - неорганічна сполука, безбарвний газ із різким задушливим запахом, легший за повітря, добре розчинний у воді. Одержують каталітичним синтезом з азоту і водню під тиском. Використовують переважно для виробництва азотних добрив, вибухових речовин і азотної кислоти. Рідкий аміак використовується в холодильних установках. Водний розчин аміаку (нашатирний спирт) застосовується в медицині.
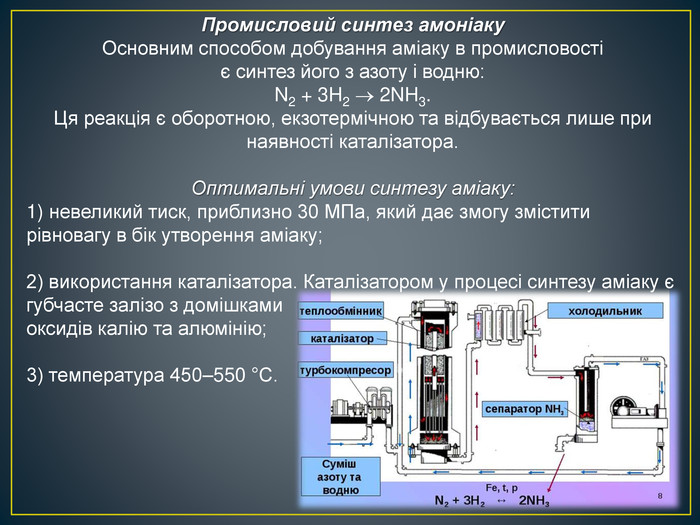
Промисловий синтез амоніаку. Основним способом добування аміаку в промисловості є синтез його з азоту і водню: N2 + 3 H2 2 NH3. Ця реакція є оборотною, екзотермічною та відбувається лише при наявності каталізатора. Оптимальні умови синтезу аміаку: невеликий тиск, приблизно 30 МПа, який дає змогу змістити рівновагу в бік утворення аміаку;2) використання каталізатора. Каталізатором у процесі синтезу аміаку є губчасте залізо з домішками оксидів калію та алюмінію;3) температура 450–550 °С.
Феєрверк (вогнеграй) - захоплююче видовище. До складу будь-якої піротехнічної суміші входять речовини-окисники і горючі речовини-відновники. Феєрверки було винайдено у Стародавньому Китаї. Перші згадки датуються 7 століттям. У Європі феєрверк вперше з'являється в Італії. З розвитком мистецького стилю шинуазрі в Європі, китайські феєрверки стали набирати популярність. В Україні вогнеграї з'являються у 18 столітті. Окисно-відновні реакції, що відбуваються в побуті
Окисно-відновні реакції відбуваються і при запалюванні сірника. До складу головки сірника входить сірка, а на бічну стінку коробки нанесено суміш червоного фосфору з калій хлоратом. Теплової енергії, яка виділяється внаслідок тертя головки сірника об стінку коробки, достатньо, аби в результаті сублімації червоного фосфору утворився білий фосфор - легкозаймиста речовина. Він взаємодіє з киснем повітря з виділенням великої кількості теплоти, необхідної для подальшого перебігу низки окисно-відновних реакцій.
Корозія металів - самопливне руйнування металів і сплавів, а також інших речовин в результаті: - хімічної, - електрохімічної або - фізико-хімічної взаємодії з навколишнім середовищем. До основних видів корозії за її механізмом відносять хімічну, електрохімічну, а також біологічну. Корозія, це природний процес, який перетворює добірний метал на більш хімічно сталу форму, таку як: його оксид, гідроксид або сульфід.
Хімічна корозія відбувається в середовищах, які не проводять електричного струму. Вона обумовлюється дією на метали неелектролітів (спирту, бензину, мінеральних мастил тощо) і сухих газів (кисню, оксидів азоту, хлору, хлороводню, сірководню та інше) при високій температурі (так звана газова корозія). У результаті взаємодії металів із зовнішнім середовищем їх поверхня вкривається тонким шаром (плівкою) різних хімічних сполук (продуктів корозії): оксидів, хлоридів, сульфідів тощо. Інколи цей шар такий щільний, що крізь нього не може проникати агресивне середовище. В таких випадках з часом швидкість корозії зменшується, а то й зовсім припиняється. Наприклад, алюміній в атмосфері повітря кородує значно повільніше від заліза, хоч за своїми хімічними властивостями він активніший від заліза. Це пояснюється тим, що поверхня алюмінію вкривається суцільною, досить щільною і міцною оксидною плівкою, яка ізолює метал від доступу кисню, а оксидна плівка заліза, навпаки, є крихкою іламкою, містить багато пор і тріщин, через що кисень повітря крізь неї легко проникає до поверхні заліза, і тим обумовлюється безперервне його руйнування.
Вежу названо на честь її конструктора Густава Ейфеля. Це найвідвідуваніша і найфотографованіша туристична пам'ятка світу. В той же час Ейфелева вежа взяла перше місце в списку пам’яток, які розчаровують туристів. Головна скарга – занадто багато відвідувачів. Була зведена як тимчасова споруда для ознаменування сторіччя з дня початку Французької революції та до відкриття паризької Всесвітньої виставки 1889 року і символізувала багатство і незалежність Франції. Вежу збирались розібрати через деякий час після завершення виставки, але завдяки уже встановленим там радіоантенам, це рішення було скасоване. Ейфелева вежа - архітектурна пам'ятка Парижа, розміщена на Марсовому полі, символ сучасної Франції.
Внизу колір темніший, а ближче до піку – світліше. Всього застосовується 3 відтінки. Колір називають Коричневий–Ейфелевий – офіційно запатентований. На нове «вбрання» йде 60 тонн фарби. Раз в 7 років на вежі 25 малярів-верхолазів протягом 18 місяців освіжають фарбу – знімають стару, покривають антикорозійним шаром, і фарбують новою.
Статуя Свободи - національний пам'ятник США, символ свободи, демократії та справедливості. Це одна з найзнаменитіших скульптур у США та у світі, часто звана «символом Нью-Йорка і США», «символом свободи і демократії», «Леді Свобода». Це подарунок французьких громадян до сторіччя американської революції.
Після встановлення, монумент прийнявся змінювати свій колір: мідь, вступила в контакт з вологим і забрудненим повітрям мегаполісу, і почала тускніти. В ході хімічної реакції мідь віддавала електрони атмосферному кисню, що призвело до виділення куприту - мінералу, що має рожевий відтінок. Хімічні реакції продовжувалися: втрачаючи електрони, куприт став теноритом, для якого характерним є темний колір.
На цьому безпосередній вплив атмосфери на пам'ятник закінчився, і в справу вступив техногенний фактор. В результаті викидів від човнів, літаків, автомобілів і фабрик в повітрі утворюється оксид сірки, який при реакції з водою виробляє сірчану кислоту. Вона ж, з'єднуючись з оксидами міді, утворює мінерали зеленого кольору. І, нарешті, остаточно зелений відтінок статуї був закріплений хлоридами, що потрапляють на неї від морських бризок. На всі ці процесипішло 30 років. Тепер мідь повністю окислена і стабільна. Час від часу міськавлада пропонували повернути Статуї Свободи її оригінальний колір, але громадськість ідею не підтримує.


про публікацію авторської розробки
Додати розробку

























