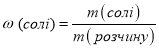Урок на тему: "Розчин і його компоненти"
Урок з хімії на тему: «Розчин і його компоненти: розчинник, розчинена речовина. Виготовлення розчину»
Підготувала Лінік О.І., вчитель хімії
Тема уроку. Розчин і його компоненти: розчинник, розчинена речовина. Виготовлення розчину.
Цілі уроку:
- освітня: поглибити знання учнів з курсу природознавства про розчин та його компоненти; ознайомити з поняттями: розчинник, розчинена речовина, масова частка розчиненої речовини;
- розвивальна: розвивати практичні навички за певними ознаками визначати воду серед інших рідин, готувати розчини; удосконалювати навички роботи з хімічними речовинами й лабораторним обладнанням;
- виховна: виховувати в учнів здатність працювати в команді, допомагати один одному, брати активну участь у пошуку нових знань; виховувати бережливе ставлення до води.
Тип уроку: набуття й поглиблення знань і навичок.
Основні терміни й поняття: розчинник, розчинена речовина.
Обладнання й матеріали: дві колби з прозорими рідинами: дистильованою водою й розчином кухонної солі, пачка кухонної солі, скляні палички; суміші: розчини різнокольорових солей, суміш крейди й води, суміш піску й води, суміш олії та води, різнокольорові осади солей у воді; лотки з обладнанням для лабораторного досліду: стакан із дистильованою водою, кухонна сіль, шпатель, скляна паличка, терези, мірний циліндр на 200 мл, стакан.
Хід уроку
І. Організаційний етап. Створення позитивного емоційного настрою
ІІ. Перевірка домашнього завдання
На попередньому уроці ми почали вивчати нову тему
Інтерактивної вправи «Скринька відповідей»
(кожен із учнів підходить і вибирає питання із скриньки)
- Чому під час кип’ятіння води в чайнику з’являється накип?
- Чи можна воду з-під крана використовувати для приготування розчинів? Яку воду використовують хіміки?
- Появу бульбашок якого газу ми спостерігаємо в разі тривалого перебування склянки з холодною водою в теплому приміщенні?
- Який газ міститься в газованій воді? Як треба зберігати пляшки з газованою водою?
- Чому лопнула банка з водою на морозі?
- Чому річкова, кринична й тала вода мають різні смаки? Яка з них найбільш чиста з хімічної точки зору?
- Якщо заповнену водою пробірку нагріти тільки у верхній її частині так, щоб вода тут закипіла, то нижня частина буде лише ледве теплою. Який висновок можна зробити про теплопровідність води?
Доповіді учнів
Перша доповідь на тему: Цей дивовижний матеріал
-Що ж це за дивовижний матеріал? Яка частина поверхні Землі вкрита водою? Який відсоток прісної води є на нашій планеті?
Друга доповідь на тему: Роль води для живих організмів
-Скільки людина може прожити днів без води?
Третя доповідь на тему: Незвичайні властивості води
- Які унікальні властивості води вас вразили найбільше?
ІІІ. Мотивація пізнавальної діяльності
У дві колби я налила дистильовану воду й розчин кухонної солі та забула підписати колби. Як мені можна розпізнати ці дві прозорі рідини?
Учні пропонують версії: за кольором не можна, за смаком теж (у хімічній лабораторії нічого куштувати не можна); можна нагріти рідини і й там, де залишиться наліт, був розчин солі;
Вчитель.А можна за густиною.
У розчині солі густина буде більше, ніж у воді (більше 1 г/см3).
Питання до класу - Чи збільшиться густина розчину, якщо ще додати води? солі?
І це показує нам що вода є розчинником?
ІV. Визначення теми, мети й завдань уроку
Вчитель. –Отже відкриваємо зошити і записуємо дату і тему нашого сьогоднішнього уроку: 22 березня Класна робота
Розчин і його компоненти. Виготовлення розчину.
Метою якого буде:
- поглибити знання про розчин та його компоненти; ознайомитись з поняттями: розчинник, розчинена речовина, масова частка розчиненої речовини; удосконалювати навички роботи з хімічними речовинами й лабораторним обладнанням; працювати в команді
- виховувати бережливе ставлення до води.
V. Вивчення нового матеріалу
Бесіда
- Що входить до складу розчину? (Розчинник, розчинена речовина)
Розчини — це багатокомпонентні системи. Один із компонентів має назву розчинник. Як правило, це речовина, яка перебуває в тому ж агрегатному стані, що й розчин. Якщо всі компоненти розчину перебувають в одному агрегатному стані, то розчинником вважають той компонент, якого в розчині більше. «Вода — універсальний розчинник усіх речовин на Землі». Найголовнішим розчинником на нашій планеті є вода, тому ми будемо готувати водні розчини. Розчиненою речовиною або речовинами можуть бути кристалічні речовини (наприклад, солі), рідини
Слайд
По відношенню до води всі речовини ділять на три групи:
• розчинні;
• малорозчинні;
• практично нерозчинні.
Розчини, на відміну від хімічних сполук, не мають постійного хімічного складу.
Вчитель.- Запишемо Розчин = розчинник + розчинена речовина
Слайд
Розчинник — речовина, яка перебуває в тому ж агрегатному стані, що й розчин (або маса якого найбільша)
Розчинена речовина може перебувати в будь-якому агрегатному стані: твердому, рідкому, газоподібному.
(Інтерактивна технологія «мозковий штурм», на дошці в центрі пускове слово «розчини», а навколо записуємо ідеї учнів.)
Назвіть приклади відомих вам розчинів та зазначте їх фізичні властивості (колір, смак, прозорість).
Передбачувані відповіді:
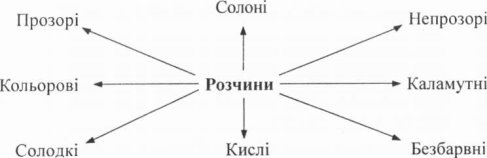
Групуємо висунуті ідеї:
Прозорі розчини → безбарвні, кольорові, солоні, солодкі, кислі.
Непрозорі розчини → каламутні.
Запитання:
- Чи всі зразки сумішей є розчинами? (Учням пропонують вибрати розчини серед запропонованих сумішей.) Розчинами є однорідні суміші.
У розчинах, на відміну від сумішей, існує взаємодія між частинками розчинника й розчиненої речовини. Подивитись у підручник….
Лабораторний дослід. Приготування розчину солі
Учні додають у стакан з 1–2 г солі 5–10 мл води й розмішують. Потім іще декілька разів додають сіль і розмішують, спостерігають момент, коли додаткова кількість солі вже не може розчинитися. Такі розчини називають насиченими.
Запитання класу
У ч и т е л ь . Для кількісного визначення вмісту розчиненої речовини хіміки вводять поняття масової частки розчиненої речовини.
Вчитель просить згадати формулу для визначення масової частки елемента, а потім вивести формулу для визначення масової частки розчиненої речовини.
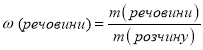
|
Дано: m(солі) = 2 г m(H2O) =198 г |
Розв’язання
m(розчину) = m (H2O) + m (солi) = 200 г.
|
|
ω(солi) − ? |
Відповідь: масова частка солі в отриманому розчині дорівнює 0,01, або 1 %.
VII. Закріплення вивченого матеріалу
Вчитель. - Проведемо вправу «Що це таке?»
♦ Речовина, що розчиняє інші речовини.
♦ Речовини, що утворюють розчин.
♦ Процес виділення речовини шляхом випаровування або охолодження його насиченого розчину.
♦Сформулюйте визначення розчину.
Демонстраційний дослід «Приготування розчину з масовою часткою солі 1 %»
Вчитель демонструє терези, зважує на них 2 г солі, мірним циліндром відміряє 198 мл води. Сіль кладе у стакан, доливає воду й готує розчин.
V. УЗАГАЛЬНЕННЯ Й СИСТЕМАТИЗАЦІЯ ЗНАНЬ
Робота в парах
|
m(солі), г |
m(H2O), г |
m(розчину), г |
w(солі) % |
|
2 |
198 |
|
|
|
4 |
|
200 |
|
|
5 |
495 |
|
|
|
|
94 |
100 |
|
|
3 |
|
|
10 |
|
|
23 |
|
8 |
VІІI. Підбиття підсумків уроку, оцінювання учнів
Оцінки отримають такі учні…
ІX. Домашнє завдання, його коментар
- Прочитати відповідний параграф підручника.
- Розв’язати задачі, заповнивши таблицю:
|
m(солі), г |
m(H2O), г |
m(розчину), г |
w(солі) % |
|
10 |
190 |
|
|
|
5 |
|
200 |
|
|
|
|
500 |
5 |
|
|
188 |
|
6 |


про публікацію авторської розробки
Додати розробку