Презентація "Оксиди:фізичні та хімічні властивості,добування та застосування"












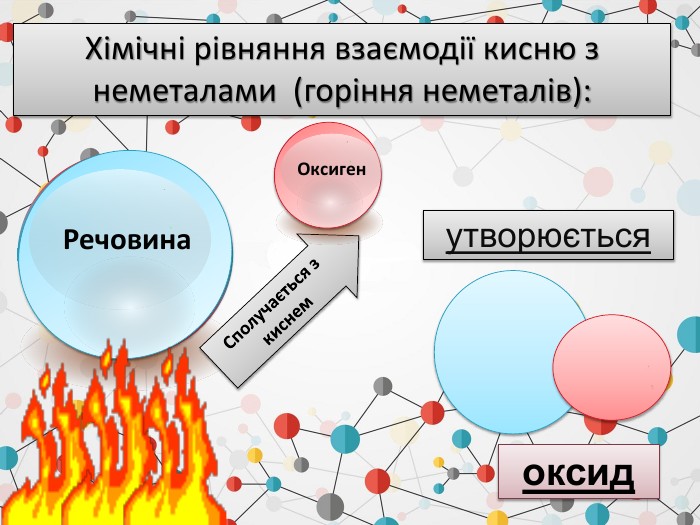







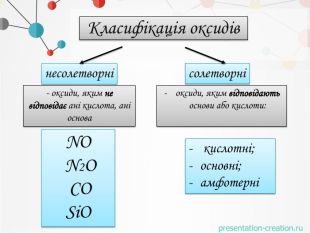
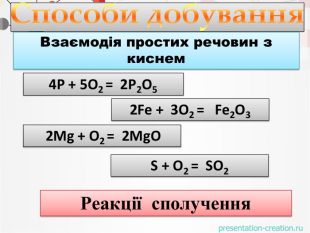
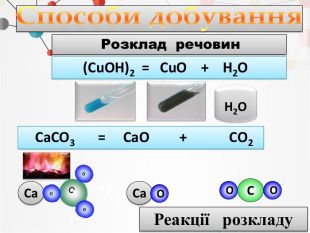
1. Записуємо два елементи, символ Оксигену завжди пишеться на другому місці. Алгоритм складання формули оксиду: Al O2. Над символами елементів ставимо валентності.ІІІІІ6233. Знаходимо найменше спільне кратне для значень валентностей. 4. Знаходимо число атомів елементів, поділивши найменше спільне кратне на значення валентностей. Оксиди - складні речовини, які складаються з двох хімічних елементів, один з яких є Оксиген
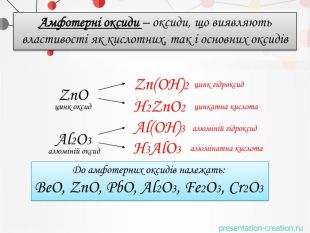
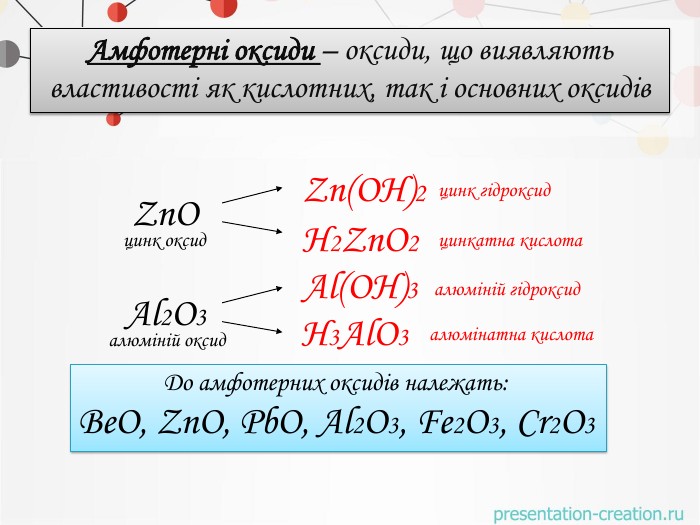
Амфотерні оксиди – оксиди, що виявляють властивості як кислотних, так і основних оксидів Zn. Oцинк оксид. Zn(OН)2цинк гідроксид. Н2 Zn. O2цинкатна кислота. Al2 O3алюміній оксид Н3 Al. O3алюмінатна кислота Al(OН)3алюміній гідроксид. До амфотерних оксидів належать: Be. O, Zn. O, Pb. O, Al2 O3, Fe2 O3, Cr2 O3
Амфотерні оксиди. Оксиди, які взаємодіють з кислотами й основами (лугами) утворюють сіль та воду називають амфотерними оксидами. Амфотерний з грецької означає і той, і інший; обидва До них належать: берилій оксид Be. O, цинк оксид Zn. O, алюміній оксид Al2 O3, плюмбум оксид Pb. O, хром (ІІІ) оксид Cr2 O3 Їм відповідають гідрати берилій гідрооксид Be(OН)2, цинк гідроксид Zn(OН)2, алюміній гідрооксид Al(OН)3, плюмбум гідрооксид Pb(OН)2, хром (ІІІ) гідрооксид Cr(OН)3
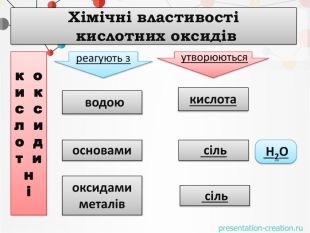
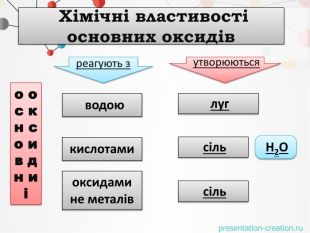
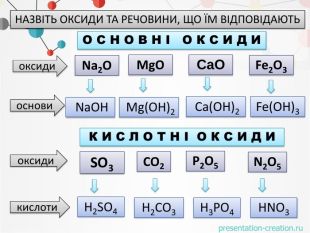
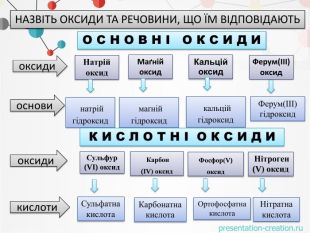
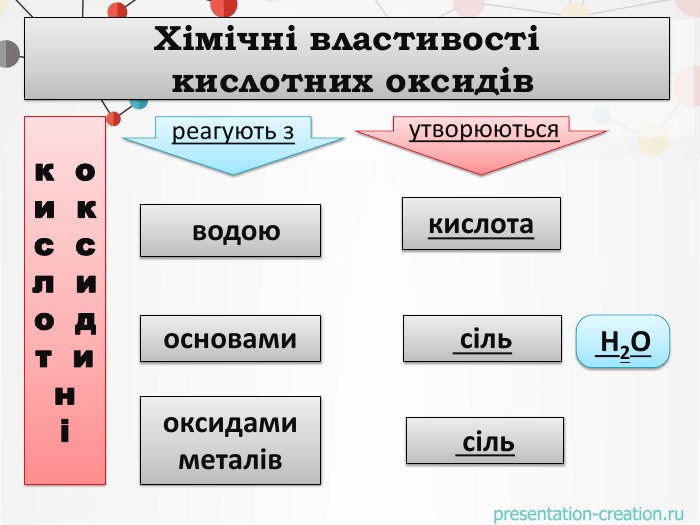
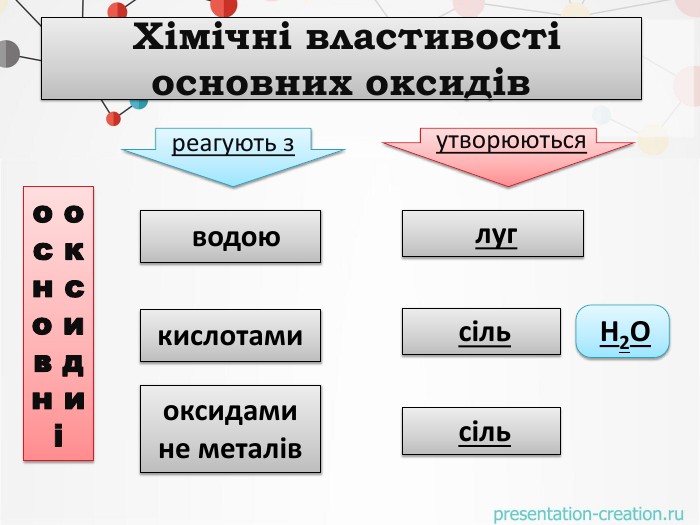
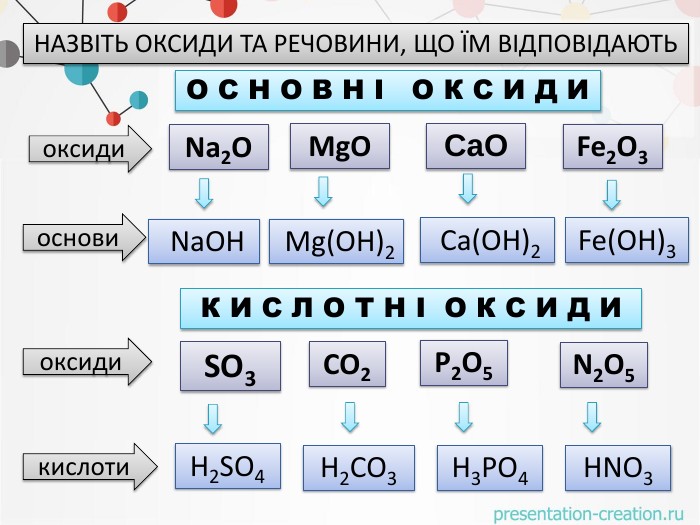
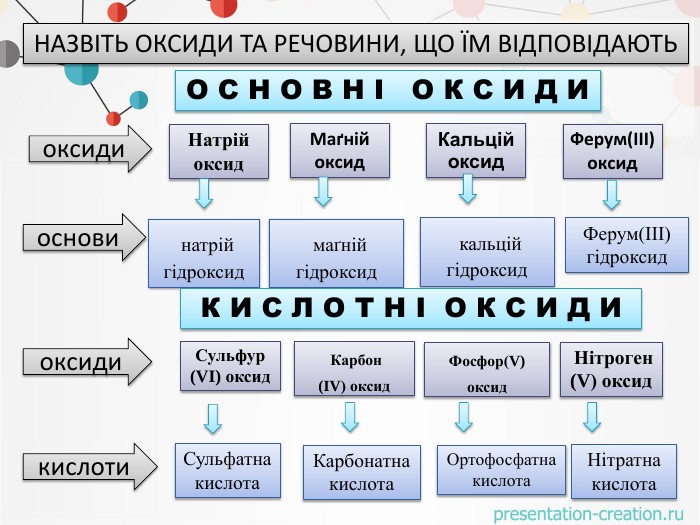
оксидиосновикислотиоксиди. Натрій оксид натрій гідроксид. Маґній оксид. Кальцій оксид. Ферум(ІІІ)оксид маґній гідроксид. Ферум(ІІІ)гідроксид кальцій гідроксид. Сульфур(VI) оксид. Фосфор(V) оксид Нітроген (V) оксид Карбон(IV) оксид. Сульфатна кислота. Карбонатна кислота. Ортофосфатна кислота. Нітратна кислота. НАЗВІТЬ ОКСИДИ ТА РЕЧОВИНИ, ЩО ЇМ ВІДПОВІДАЮТЬО С Н О В Н І О К С И Д ИК И С Л О Т Н І О К С И Д И

про публікацію авторської розробки
Додати розробку