Презентація по темі: "Кристалічний і аморфний стани твердих речовин"
Про матеріал
Презентація по темі: "Кристалічний і аморфний стани твердих рчовин".
Містить матеріали, які характеризують будову речовин.
Перегляд файлу
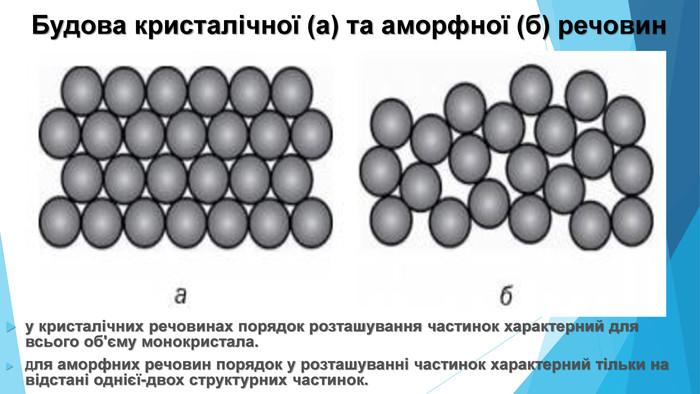
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
-
Дякую за чудову розробку !
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку


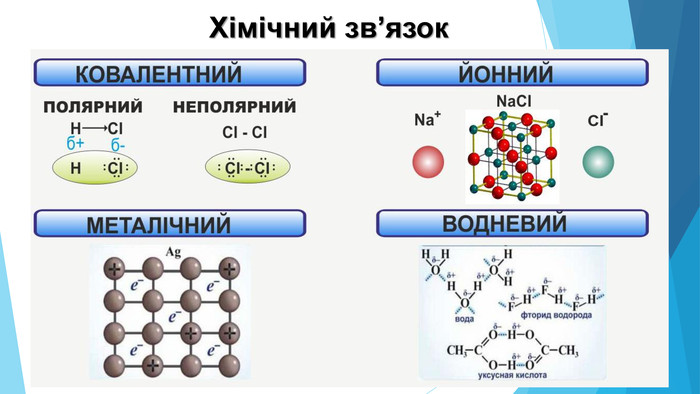


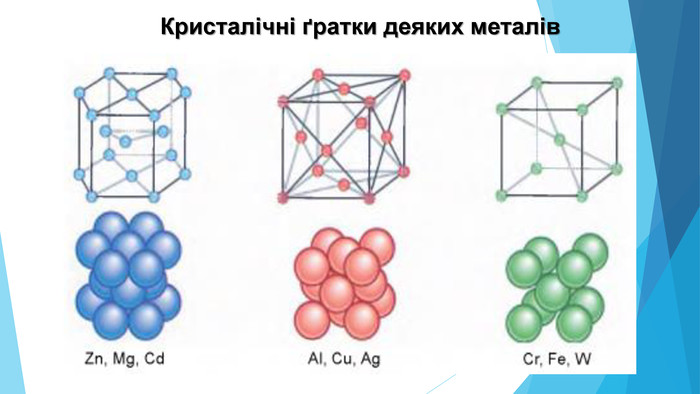
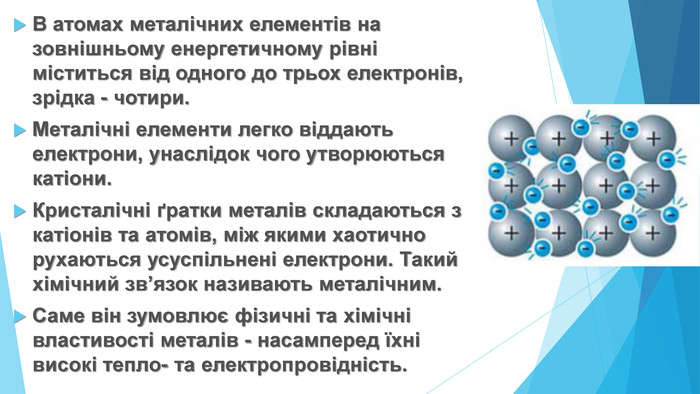



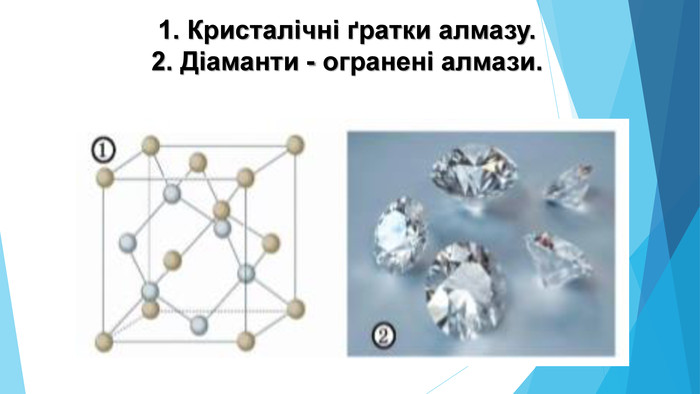
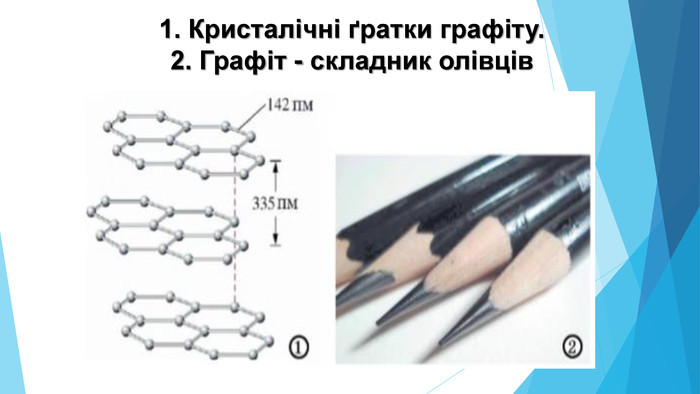




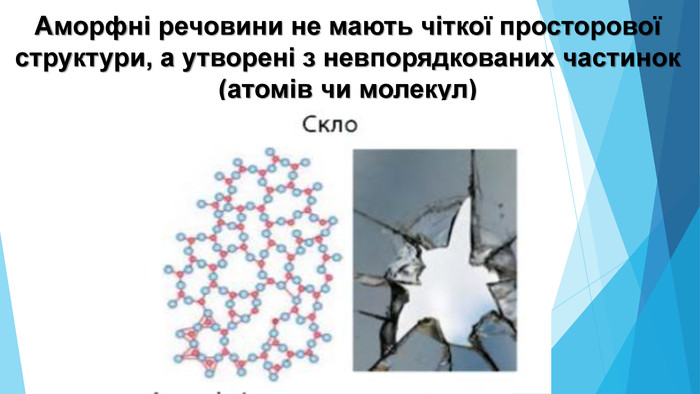
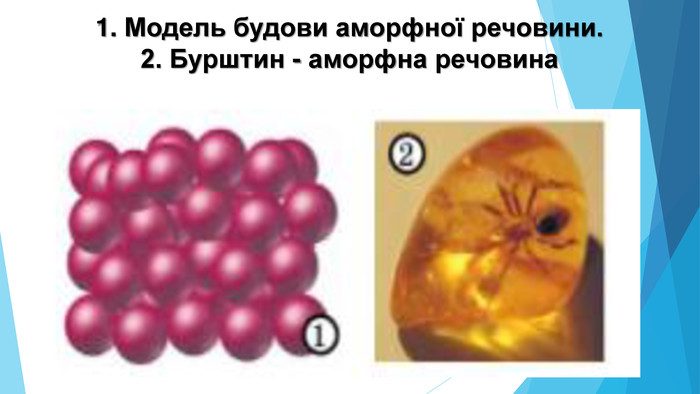



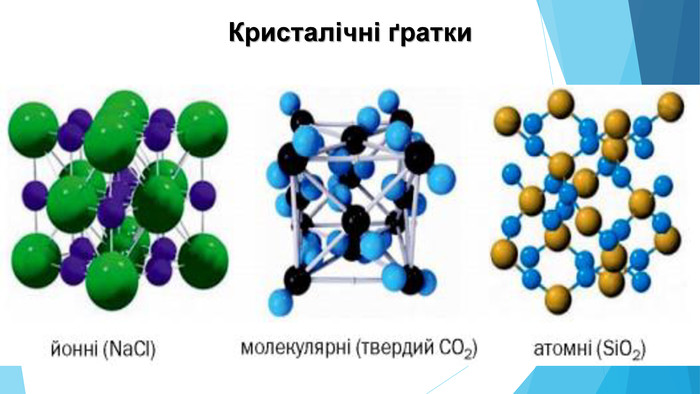
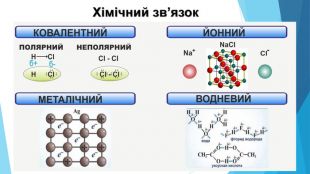
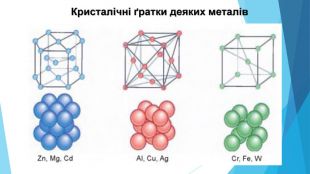
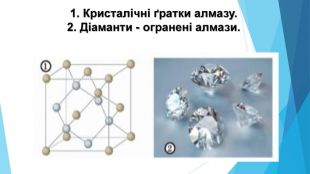
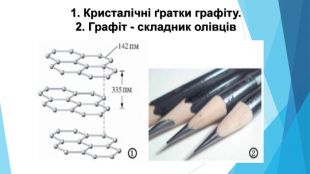
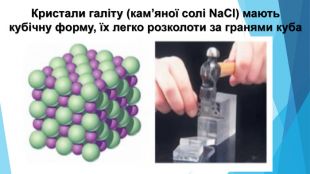
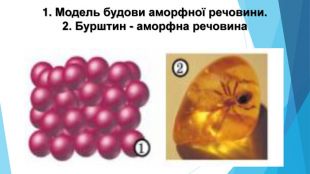
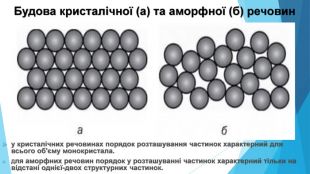
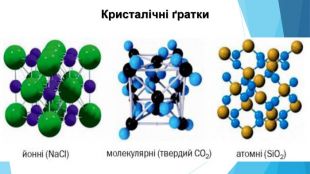
![Модель внутрішньої будови кристала називають кристалічними ґратками. Це — схема чи макет розміщення найменших частинок у невеликому об’ємі кристала. Відповідно до будови речовин розрізняють йонні, молекулярні та атомні кристалічні ґратки. Берил Al2 Be3[Si6018] Модель внутрішньої будови кристала називають кристалічними ґратками. Це — схема чи макет розміщення найменших частинок у невеликому об’ємі кристала. Відповідно до будови речовин розрізняють йонні, молекулярні та атомні кристалічні ґратки. Берил Al2 Be3[Si6018]](/uploads/files/488081/125863/137371_images/22.jpg)