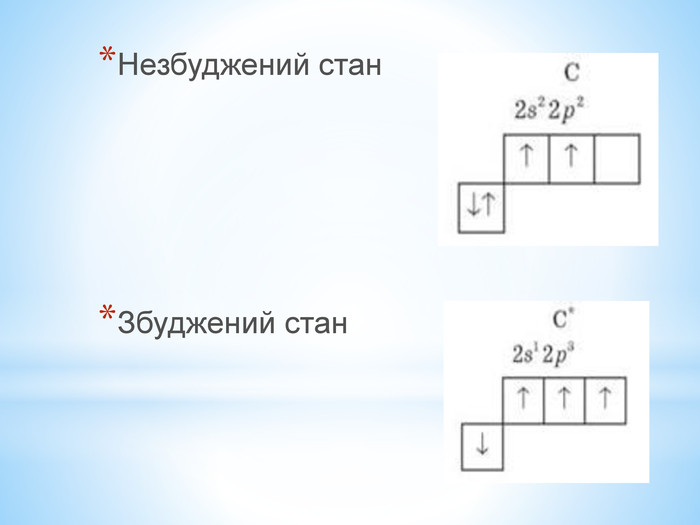
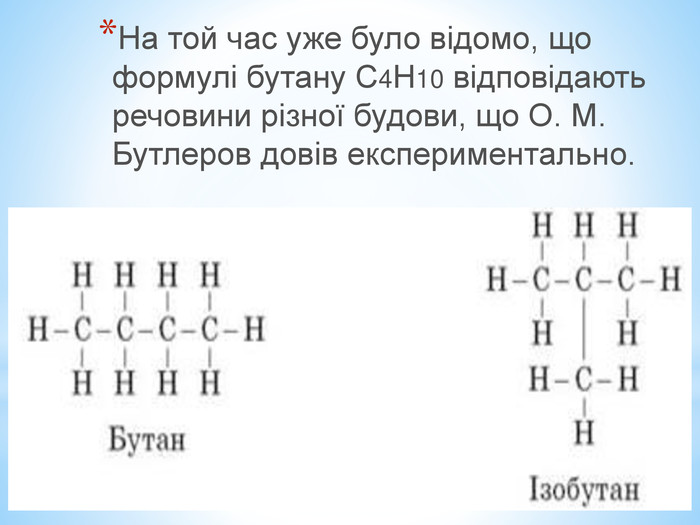
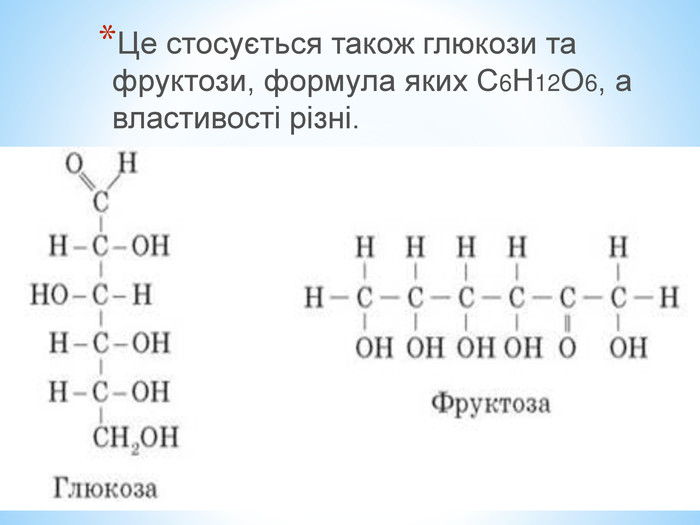
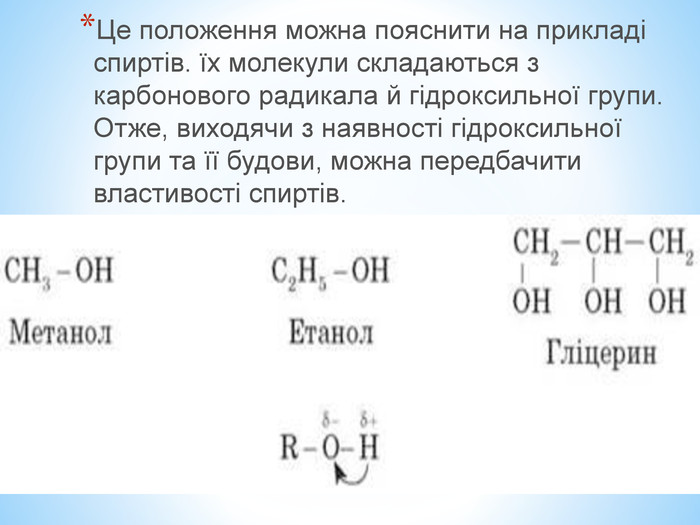
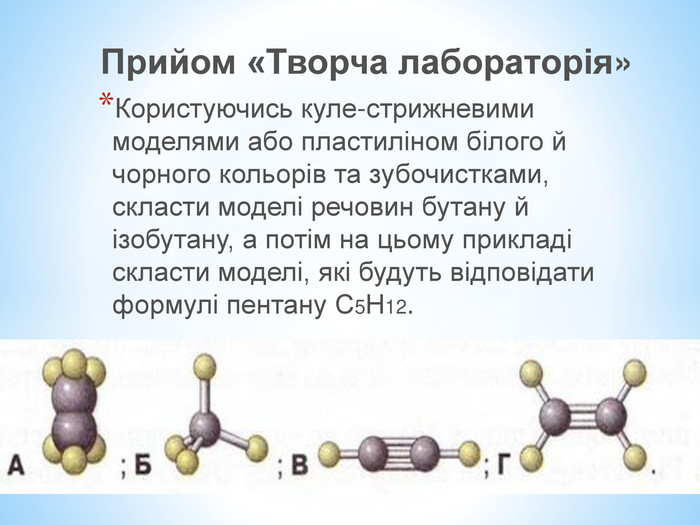
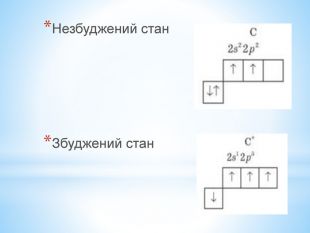
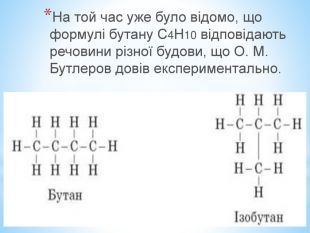
Презентація по темі: "Теорія хімічної будови органічних речовин О. М. Бутлерова"
Про матеріал
Презентація по темі: "Теорія хімічної будови органічних речовин О. М. Бутлерова" Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
ДЯКУЮ!!!!!
-
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку