Презентація «Полярний ковалентний зв’язок» 8 клас
| Презентація допоможе в проведенні уроку на тему: «Ковалентний зв'язок.» Полярний ковалентний зв'язок, його утворення. Електронегативність. Електронні формули молекул. |




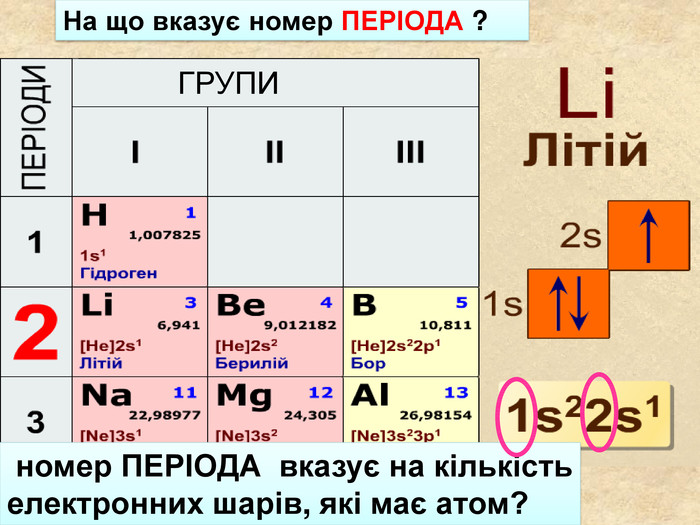
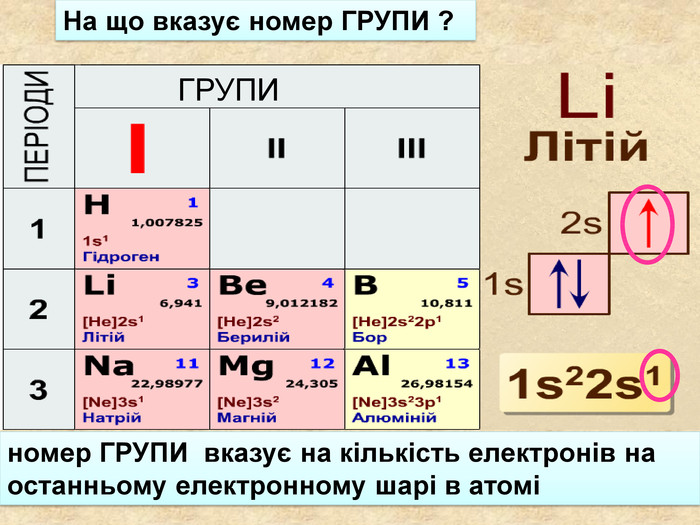




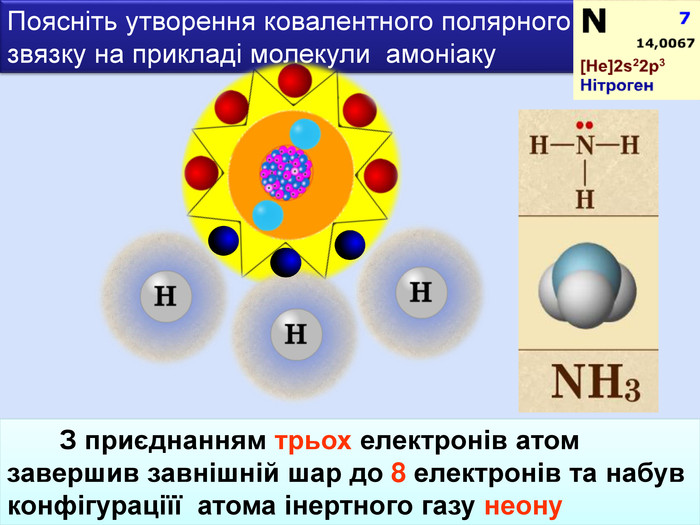
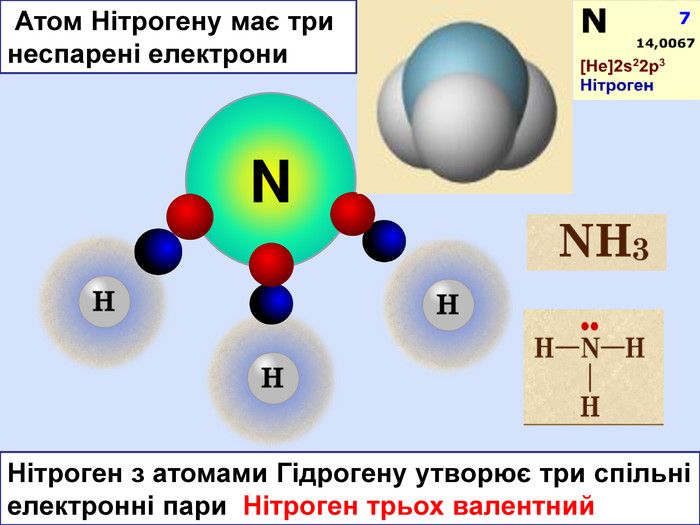




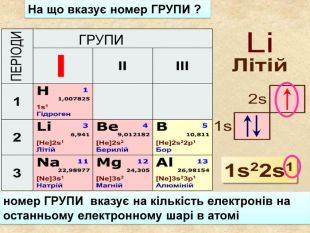
Хімічний зв'язок утворюється за рахунок перекривання орбіталей різних атомів і за рахунок взаємодії наспарених електронів цих атомів. В утворенні хімічного звязку прийають участь електрони останніх електронних шарів.Їх ще називають валентні електрони При утворенні хімічного зв'язку зовнішні електронні шари атомів набувають електронної конфігурації найближчого інертного елемента із восьми електронів Ar0 Ne0 Нe0
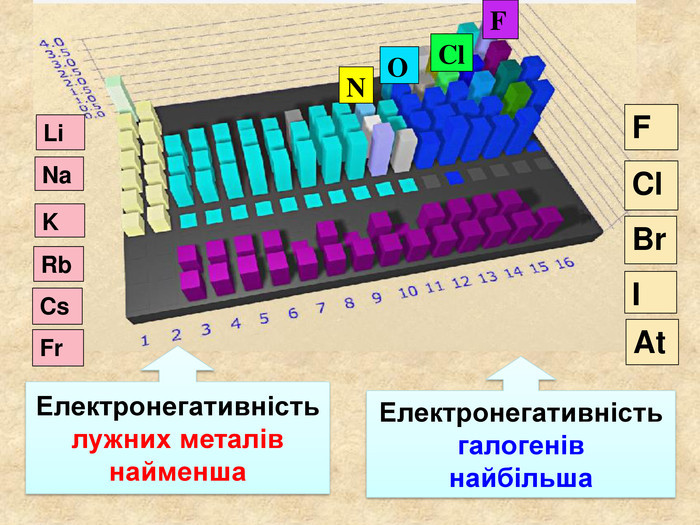
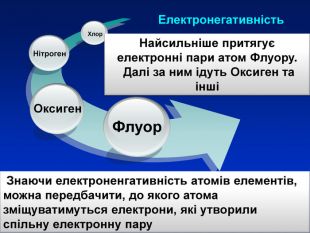
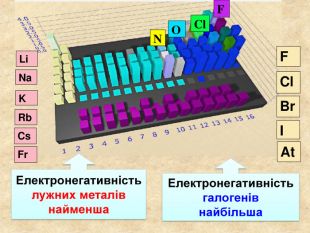
При утворенні спільної електроної пари двома атомами різних хімічних елементів один з них притягує її сильніше ніж інший. Електронегативність Електронегативність ― умовна величина, яка характеризує здатність атома в сполуці притягувати до себе електрони За одиницю електронегативності прийнято електронегативність Літію, і з нею порівнюють електронегативності інших елементів
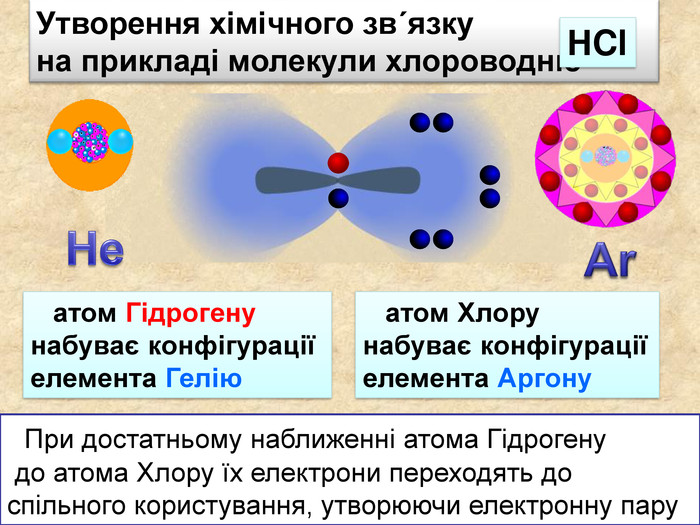
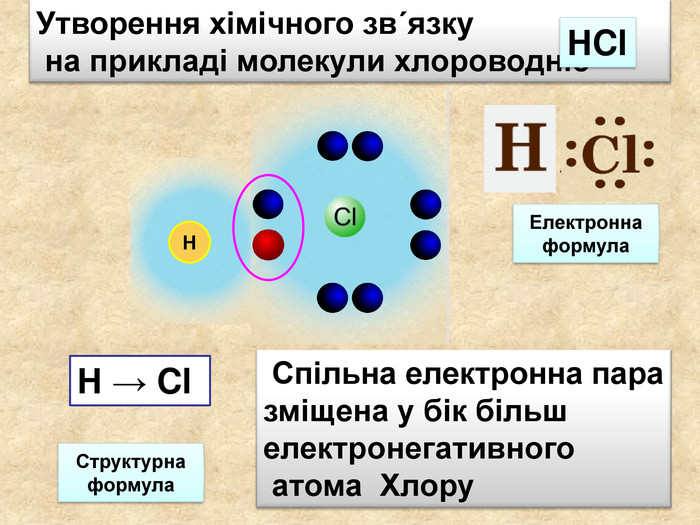
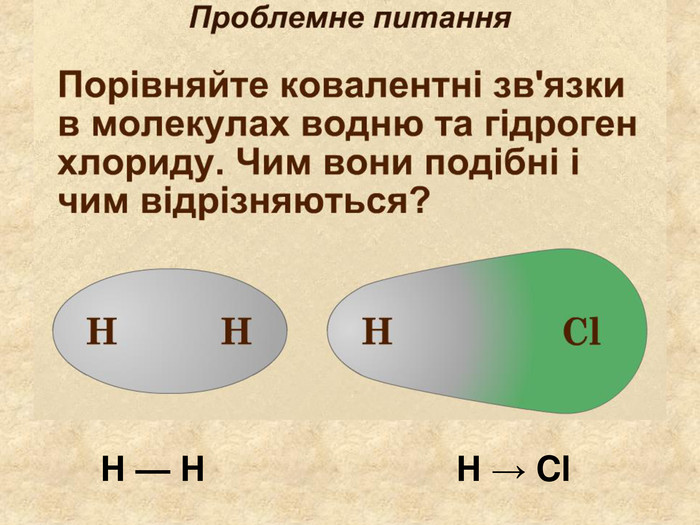
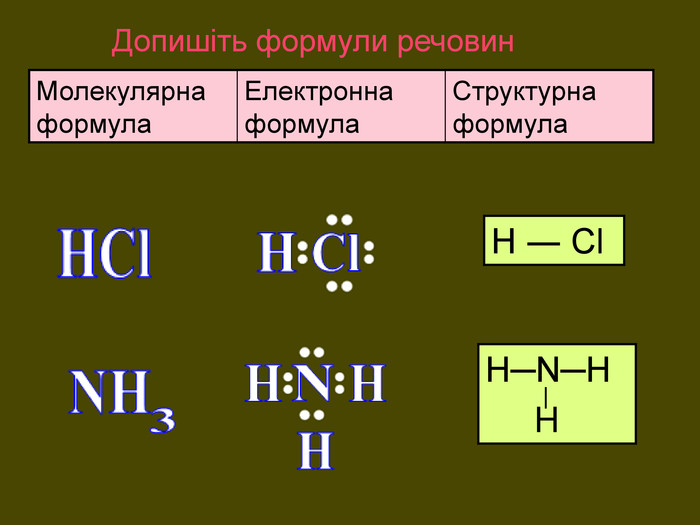
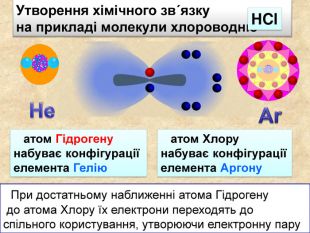
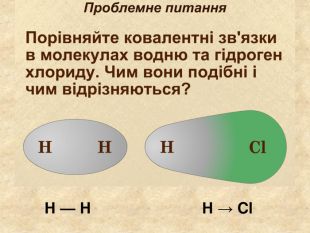
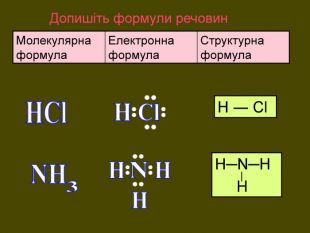
Утворення хімічного зв΄язку на прикладі молекули хлороводню При достатньому наближенні атома Гідрогену до атома Хлору їх електрони переходять до спільного користування, утворюючи електронну пару. Не атом Гідрогену набуває конфігурації елемента Гелію атом Хлору набуває конфігурації елемента Аргону Ar НCl. Cl. Н
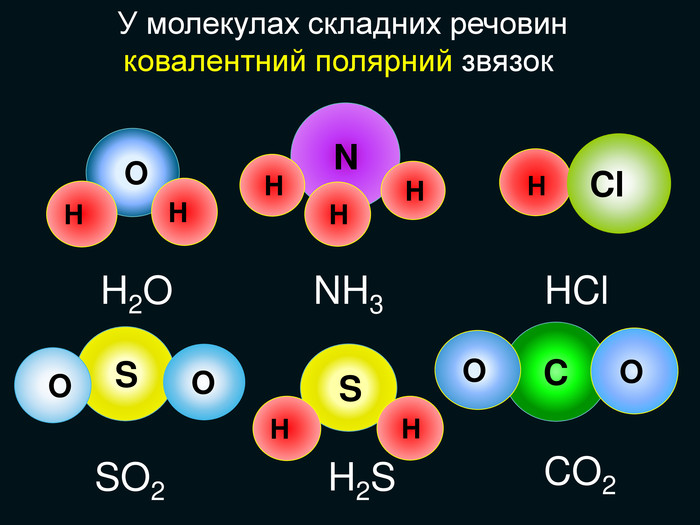
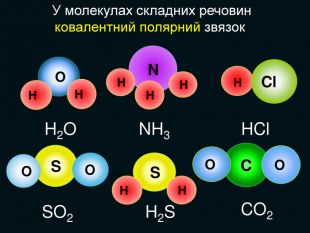
НCl N H H OHH H SH H S O O C O OH2 OSO2 H2 SCO2 NH3 HCl У молекулах складних речовин ковалентний полярний звязокstyle.colorfillcolorfill.typefill.onrrrrrstyle.colorfillcolorfill.typefill.onrrrrrstyle.colorfillcolorfill.typefill.onrrrrrstyle.colorfillcolorfill.typefill.onrrrrrstyle.colorfillcolorfill.typefill.onrrrrrstyle.colorfillcolorfill.typefill.onrrrrr
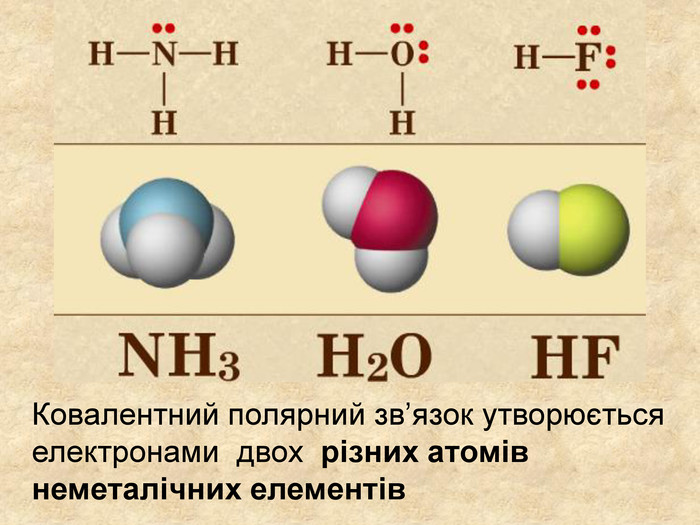
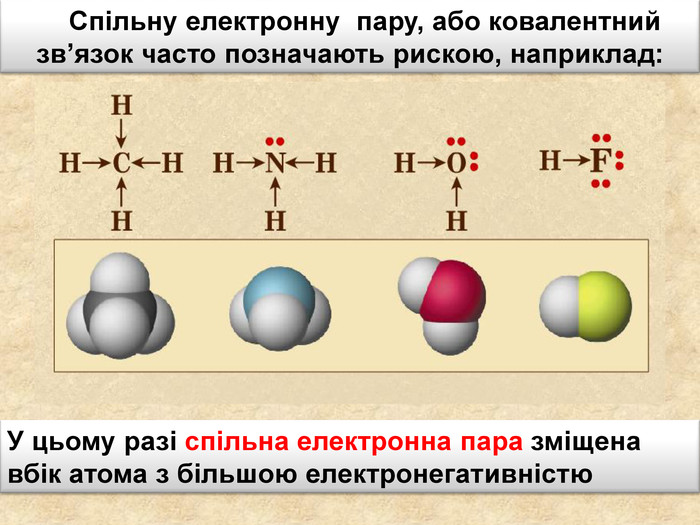
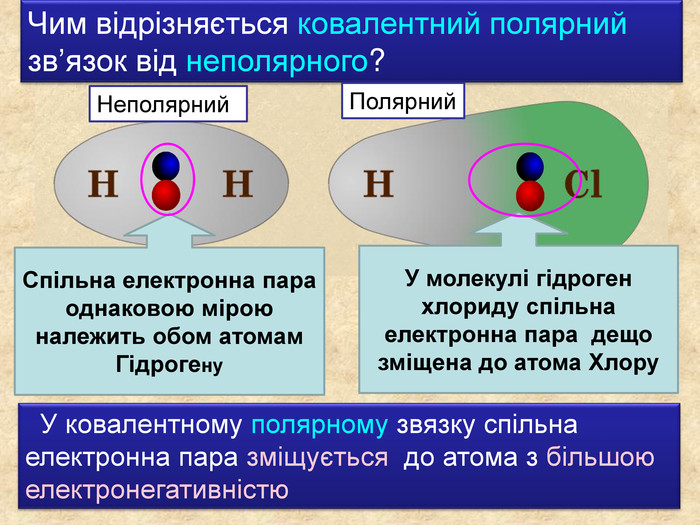
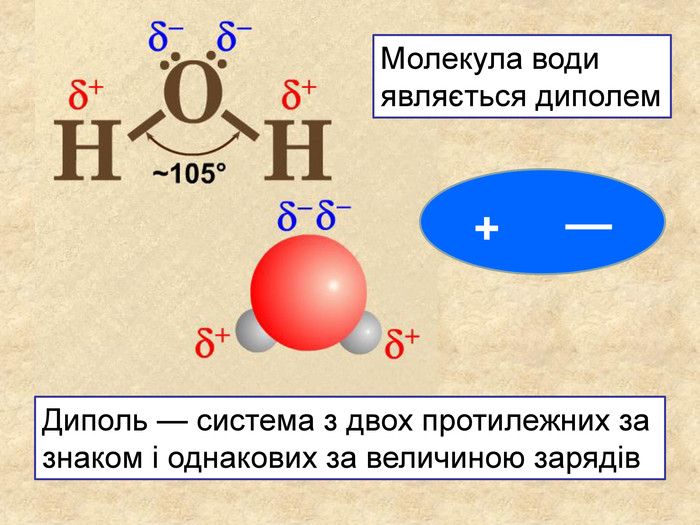
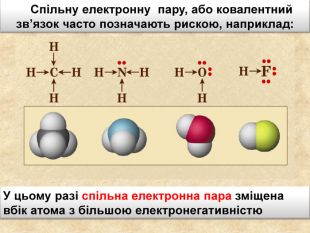
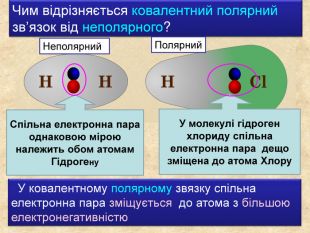
У ковалентному полярному звязку спільна електронна пара зміщується до атома з більшою електронегативністю. Чим відрізняється ковалентний полярний зв’язок від неполярного?Спільна електронна пара однаковою мірою належить обом атомам Гідрогену. У молекулі гідроген хлориду спільна електронна пара дещо зміщена до атома Хлору. Неполярний Полярний
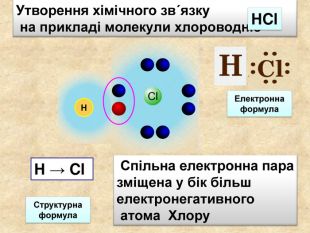
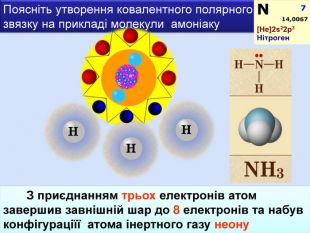
Поясніть утворення ковалентного полярного звязку на прикладі молекули хлороводню У молекул хлороводню НCl атом Гідрогену зарахунок “чужого” електрона завершує перший енергетичний рівень, а атом Хлору ― третій У цьому разі спільна електронна пара зміщується вбік до атома Хлору Такий зв’язок називається полярним.+→ Ar. НCl. Н→ Cl
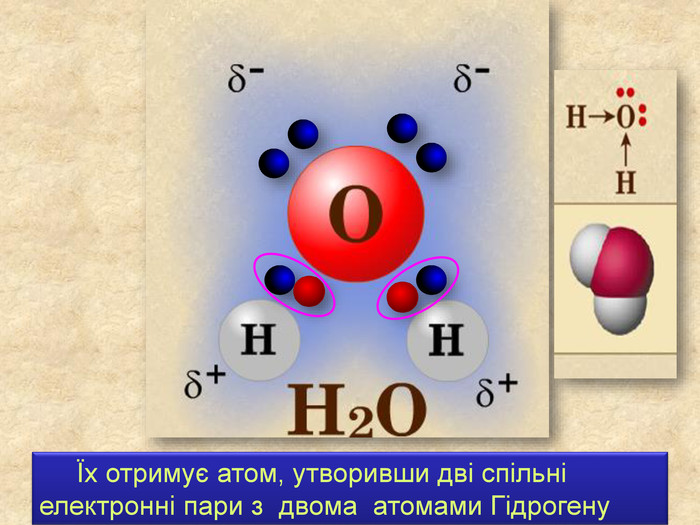
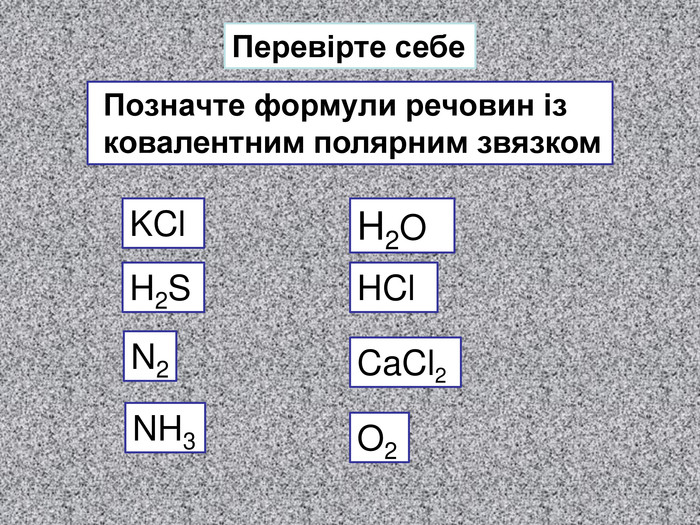
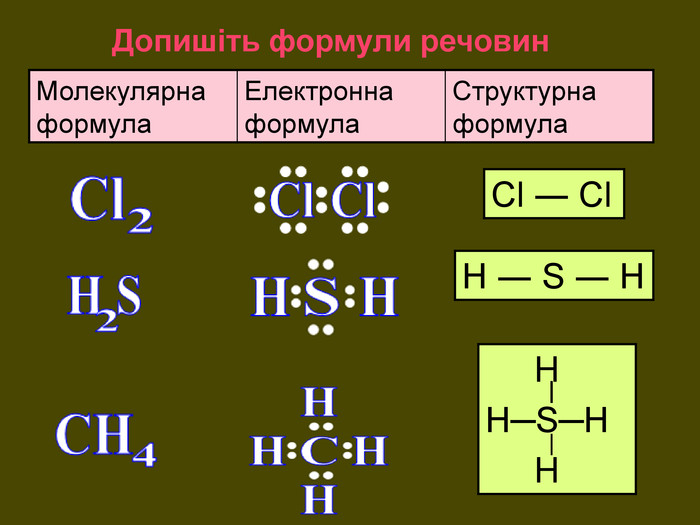
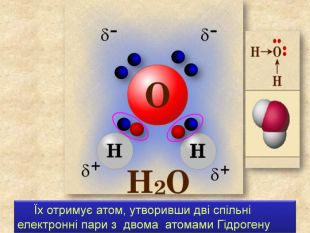
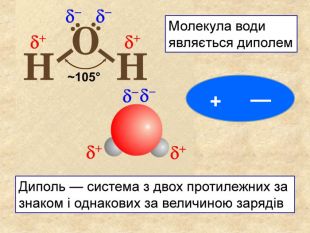
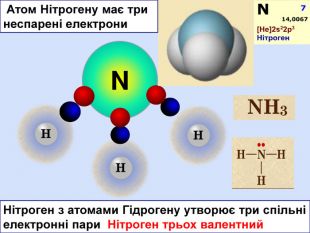
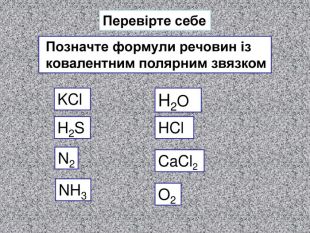
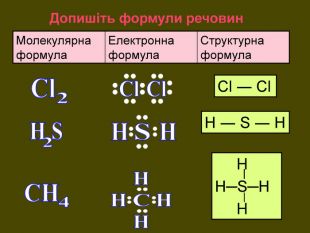
Хімічний зв’язок, який утворюється за допомогою спільних електронних пар, які зщміщені в бік електронгативного атома, називається ковалентним полярним зв'язком До речовин з ковалентним полярним зв’язоком відносяться речовини, утворені атомами неметалічних елементів, що мають різну електронегативність:хлороводень HCl, вода H2 O, сірководень H2 S, метан CH4
Григорович О. В. Хімія: підруч. для 8 класу загальноосвіт. навч.закл./ О. В. Григорович .̶ Харків: Вид-во «Ранок», 2016 Шаповалов С. А. Хімія. Довідник старшокласника та абітурієнта. Харків. Торсінг, 2005. Данильченко В.Є Халімон Є. В. Хімія. Навчальний посібник. 8-9 класи – Харків.: Країна мрій, 2008. – 128с.


про публікацію авторської розробки
Додати розробку














-

Бузницька Ольга Миколаївна
04.12.2023 в 14:24
Дякую, колего!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Фесенко Надежда
09.11.2022 в 16:47
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Велика Наталія Миколаївна
01.11.2021 в 18:52
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Мушій Валентина Миколаївна
12.11.2019 в 06:10
Дякую за розробку. Ілюстрації допомагають зрозуміти суть процесів.
Загальна:
4.3
Структурованість
4.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Субботіна Альона Вікторівна
11.11.2019 в 15:25
Дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 2 відгука