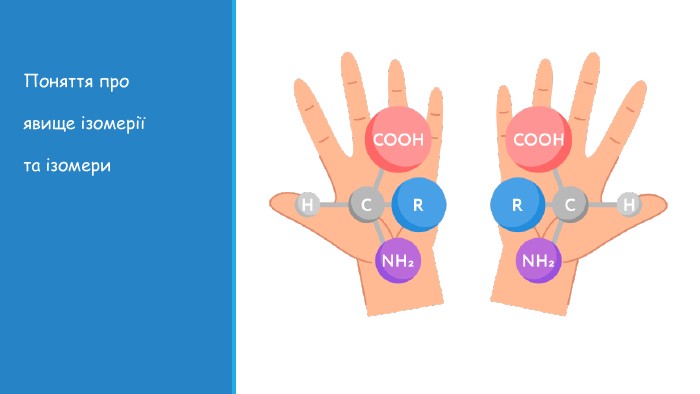
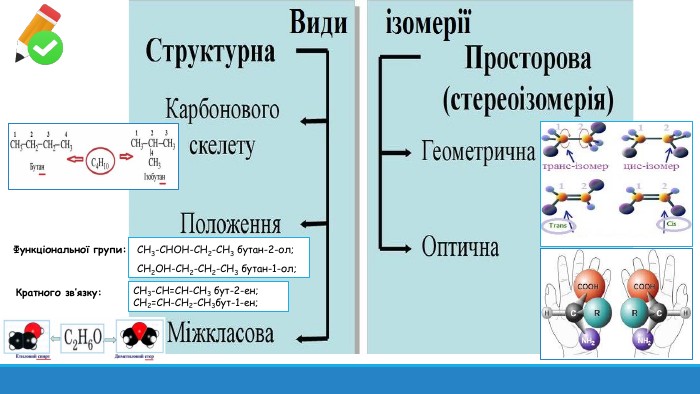
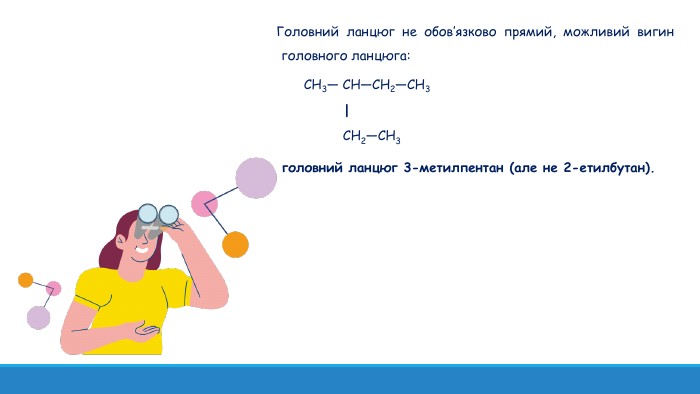
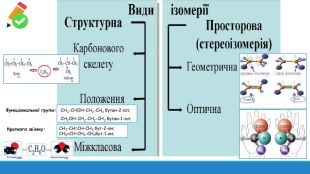
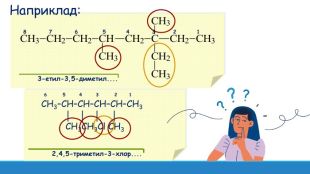
Презентація: "Поняття про явище ізомерії та ізомери".
Про матеріал
Презентація до уроку з хімії на тему: " Поняття про явище ізомерії та ізомери" за підручником Григорович О.В. Хімія 10 клас Рівень стандарту Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку