Презентація "Розрахунки за хімічними рівняннями маси, об'єму, кількості речовини реагентів та продуктів реакцій."
Про матеріал
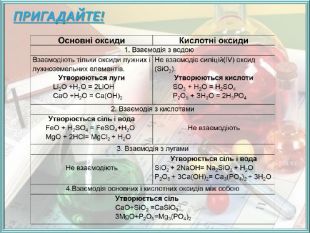
Матеріал містить тренувальні вправи з розв'язками з теми "Розрахунки за хімічними рівняннями маси, об'єму, кількості речовини реагентів та продуктів реакцій." Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку


























-

Журавльова Валентина Миколаївна
02.11.2025 в 12:45
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Велика Наталія Миколаївна
28.10.2025 в 20:01
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Лаптєва Інна
08.04.2025 в 10:28
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Фертак Наталя Володимирівна
10.03.2025 в 21:07
Дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Кикоть Елена
25.02.2025 в 21:34
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Чорна Алла
24.02.2025 в 07:30
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Грищенко Ирина
22.02.2025 в 17:38
дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Леденьова Ірина Миколаївна
19.04.2023 в 17:41
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 5 відгуків